
【題目】原電池的電極名稱不僅與電極材料的性質有關,也與電解質溶液有關。下列說法中正確的是( )
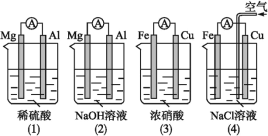
A.(1)(2)中Mg作負極,(3)(4)中Fe作負極B.(2)中Mg作正極,電極反應式為6H2O+6e-=6OH-+3H2↑
C.(3)中Fe作負極,電極反應式為Fe-2e-=Fe2+D.(4)中Cu作正極,電極反應式為2H++2e-=H2↑
【答案】B
【解析】
A.(2)中的氧化還原反應發生在金屬鋁和氫氧化鈉之間,失電子的是金屬鋁,Al為負極,(3)中金屬鐵在常溫下遇濃硝酸鈍化,銅做負極,故A錯誤;
B.(2)中的氧化還原反應發生在金屬鋁和氫氧化鈉之間,失電子的是金屬鋁,Al為負極,電極反應為:Al-3e-+4OH-=AlO2-+2H2O,Mg作為正極,電極反應式為2H2O+2e-═2OH-+H2↑,故B正確;
C.(3)中銅作負極發生氧化反應,所以銅失電子生成銅離子,即電極反應式為Cu-2e-═Cu2+,故C錯誤;
D.鐵、銅、氯化鈉溶液構成的原電池中,金屬鐵為負極,金屬銅為正極,鐵發生的是吸氧腐蝕,正極上是氧氣得電子的過程,電極反應式為O2+4e-+2H2O=4OH-,故D錯誤;
答案為B。


科目:高中化學 來源: 題型:
【題目】閱讀短文,回答問題。
鋰離子電池是一種生活中常見的二次電池,常用于手機、筆記本電腦、電動車中。它主要依靠Li+在正極材料(LixCOO2)和負極材料(石墨)之間往返嵌入和脫嵌來工作。低溫時,由于電解液粘度增大,電池中鋰離子的遷移能力下降。低溫充電時石墨嵌鋰速度降低,Li+來不及嵌入石墨中形成LixC,便得到電子被還原,容易在負極表面析出金屬鋰,降低電池容量,影響電池安全。上海復旦大學開發了一款新型鋰離子電池,其放電的工作原理如圖1所示。該電池不僅在-40℃下放電比容量沒有衰降,甚至在-70℃下該電池的容量保持率也能夠達到常溫的70%左右,極大地拓展了電池的應用范圍。復旦大學團隊采用凝固點低、可在極端低溫條件下導電的乙酸乙酯基電解液,并采用不需要將鋰離子嵌入到電極中即可完成充、放電的有機物電極,避免了低溫條件下嵌入過程變慢。請依據文章內容回答下列問題。
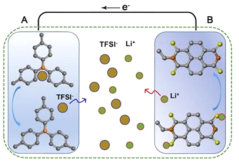
(1)判斷下列說法是否正確_________(填“對”或“錯”)。
①新型鋰離子電池有望在地球極寒地區使用。
②在傳統鋰離子電池中,金屬鋰是負極材料。
③若新型鋰離子電池在常溫下的放電比容量為99mAh·g-1,則其在-40℃下的放電比容量為99mAh·g-1。
(2)新型鋰離子電池放電時,正極是_________(填“A”或“B”)。
(3)下列關于該新型鋰離子電池可耐低溫原因的推測中,不正確的是_________(填字母)。
a.采用與傳統不同的有機物電極
b.乙酸乙酯基電解液的凝固點低
c.鋰離子不需要在正負極間移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是
A. △H<0的反應一定能自發反應進行。
B. 對于一個給定的反應,選擇合適的催化劑可以大幅度提升正逆反應速率和反應物轉化率。
C. 鐵與稀硫酸反應制取氫氣,向溶液中加入少量的CuSO4固體可以加快化學反應速率
D. 在恒溫恒壓的密閉容器中進行反應2NO+O2![]() 2NO2,達到平衡后充入He,平衡不移動。
2NO2,達到平衡后充入He,平衡不移動。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W、R 是現在元素周期表中的短周期元素,原子序數依次增大。X原子核外各層電子數之比為 1:2,Y 原子和Z原子的外電子數之和為20,W和R是同周期相鄰元素,Y的氧化物和R的氧化物均能形成酸雨。
請回答下列問題:
(1)元素X的最高價氧化物的電子式為_____,元素Z的離子結構示意圖為_____。
(2)單質銅和元素Y的最高價氧化物對應水化物的稀溶液發生反應的化學方程式為__。
(3)元素W非金屬性比元素R弱,用原子結構的知識解釋原因_____。
(4)R的一種氧化物能使品紅溶液褪色,工業上用Y的氣態氫化物的水溶液做其吸收劑,寫出吸收劑與足量該氧化物反應的離子方程式_____。
(5)Y和Z組成的化合物 ZY,被大量用于制造電子元件。工業上用Z的氧化物、X單質和Y單質在高溫下制備ZY,其中Z的氧化物和X單質的物質的量之比為1:3,則該反應的化學方程式為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丙烯是一種重要的有機化工原料,用于制丙烯腈、環氧丙烷、丙酮等。回答下列問題:
(1)已知:
I.C3H8(g)![]() C3H6(g)+H2(g) △H1=+124kJ/mol
C3H6(g)+H2(g) △H1=+124kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
則丙烷氧化脫氫制丙烯反應2C3H8(g)+O2(g)![]() 2C3H6(g)+2H2O(g)的△H為_________kJ/mol。
2C3H6(g)+2H2O(g)的△H為_________kJ/mol。
(2)我國學者結合實驗與計算機模擬結果,研究了丙烷在六方氮化硼催化劑表面氧化脫氫制丙烯的反應歷程如圖所示,其中吸附在催化劑表面的物種用*標注。
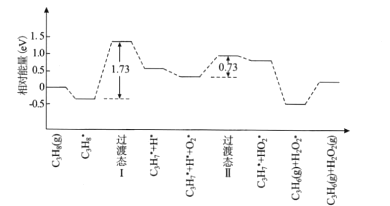
①該反應歷程中決速步驟的能壘(活化能)為_________eV,該步驟的化學方程式為________
②請補充該歷程之后可能發生的化學反應方程式_____________
(3)已知丙烷氧化脫氫容易發生副反應:2C3H8(g)+O2(g)![]() 3C2H4(g)+2H2O(g)如圖所示是丙烷氧化脫氫制丙烯反應達到平衡時丙烷轉化率與丙烯選擇性隨溫度變化的曲線[丙烯的選擇性=n=
3C2H4(g)+2H2O(g)如圖所示是丙烷氧化脫氫制丙烯反應達到平衡時丙烷轉化率與丙烯選擇性隨溫度變化的曲線[丙烯的選擇性=n=![]() ×100%]
×100%]
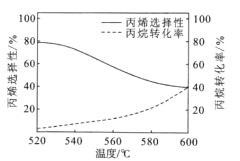
①丙烯的選擇性隨著溫度的升高而降低的可能原因有_________
②在反應溫度為600℃,將C3H8與O2以體積比為1:1充入剛性容器中,達到平衡時,丙烷的轉化率為40%,丙烯的選擇性也為40%,體系總壓強為pkPa,則氧氣的轉化率![]() (O2)=______________丙烯的分壓p(C3H8)=____________(結果保留2位有效數字)。
(O2)=______________丙烯的分壓p(C3H8)=____________(結果保留2位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為 NaCl 晶胞結構示意圖(晶胞邊長為 a nm)。
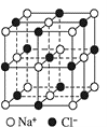

(1)能準確證明其是晶體的方法是_____
(2)晶體中,Na+位于Cl-所圍成的正_____面體的體心, 該多面體的邊長是_____nm。
(3)晶體中,在每個Na+的周圍與它最近且等距離的 Na+共有_____個。
(4)Na+半徑與 Cl-半徑的比值是_________(保留小數點后三位, ![]() =1.414。
=1.414。
(5)在 1413℃時,NaCl 晶體轉變成氯化鈉氣體。現有 5.85 g NaCl 晶體,使其汽化,測得氣體體積為 1.12 L(已換算為標準狀況)。則此時氯化鈉氣體的分子________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水合肼(N2H4·H2O)是一種強還原性的堿性液體,常用作火箭燃料。利用尿素法生產水合肼的原理為CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl。
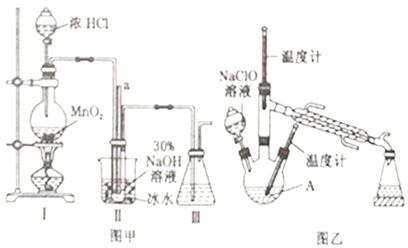
實驗1:制備NaClO溶液(己知:3NaClO![]() 2NaCl+NaClO3)。
2NaCl+NaClO3)。
(1)圖甲裝置Ⅰ中燒瓶內發生反應的離子方程式為________________________。
(2)用NaOH固體配制溶質質量分數為30%的NaOH溶液時,所需玻璃儀器有_______________。
(3)圖甲裝置Ⅱ中用冰水浴控制溫度的目的是________________________。
實驗2:制取水合肼
(4)圖乙中若分液漏斗滴液速度過快,部分N2H4·H2O會參與A 中反應并產生大量氮氣,降低產品產率,該過程中反應生成氮氣的化學方程式為__________________。充分反應后,蒸餾A中溶液即可得到水合肼的粗產品。
實驗3:測定餾分中水合肼的含量
(5)稱取餾分3.0g,加入適量NaHCO3固體(滴定過程中,調節溶液的pH 保持在6.5 左右),加水配成250mL溶液,移出25.00mL置于錐形瓶中,并滴加2~3 滴淀粉溶液。用0.15mol·L-1的碘的標準溶液滴定。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定操作中若不加入適量NaHCO3固體,則測量結果會___________“偏大”“ 偏小”“ 無影響”)。
②下列能導致餾分中水合肼的含量測定結果偏高的是___________(填字母)。
a.錐形瓶清洗干凈后未干燥
b.滴定前,滴定管內無氣泡,滴定后有氣泡
c.讀數時,滴定前平視,滴定后俯視
d.盛標準液的滴定管水洗后,直接裝標準液
③實驗測得消耗I2溶液的平均值為20.00mL,餾分中水合肼(N2H4·H2O)的質量分數為___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用廢鐵屑制備磁性膠體粒子,制取過程如下:

下列說法不正確的是
A. 用Na2CO3溶液浸泡是為了除去廢鐵屑表面的油污
B. 通入N2是防止空氣中的O2氧化二價鐵元素
C. 加適量的H2O2是為了將部分Fe2+氧化為Fe3+,涉及反應:H2O2+2Fe2++2H+=2Fe3++2 H2O
D. 溶液A中Fe2+和Fe3+的濃度比為2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】W、M、X、Y、Z是周期表前36號元素中的四種常見元素,其原子序數依次增大。W的一種核素在考古時常用來鑒定一些文物的年代;M的氧化物是導致酸雨的主要物質之一。X的某一種單質是大氣污染物監測物之一;Y的基態原子核外有6個原子軌道處于半充滿狀態;Z能形成紅色的Z2O和黑色的ZO兩種氧化物。
(1)Y3+基態的電子排布式可表示為 。
(2)MX3-的空間構型 (用文字描述)。
(3)M可形成多種氫化物,其中MH3的堿性強于M2H4的原因是 。
(4)根據等電子原理,WX分子的結構式為 。
(5)1 mol WX2中含有的σ鍵數目為 。
(6)H2X分子中X原子軌道的雜化類型為 。
(7)向Z2+的溶液中加入過量NaOH溶液,可生成Z的配位數為4的配位離子,寫出該配位離子的結構式 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com