
某校化學研究性學習小組欲設計實驗驗證Al、Fe、Cu的金屬活動性,他們提出了以下兩種方案。請你幫助他們完成有關實驗項目:
(1)用三種金屬與鹽酸反應的現象來判斷,實驗中除選擇大小相同的金屬片外,還需要控制
_____________ 、_____________ 相同;若選用一種鹽溶液驗證三種金屬的活潑性,該試劑為 。
(2)①若用Fe、Cu作電極設計成原電池,以確定Fe、Cu的活動性。試在下面方框中畫出原電池裝置圖,標出原電池的電極材料和電解質溶液。
上述裝置中正極反應式為 。
②某小組同學采用Al、Fe作為電極,只用一個原電池證明三種金屬的活動性,則電解質溶液最好選用 。
| A.0.5 mol·L-1氯化亞鐵溶液 | B.0.5 mol·L-1氯化銅溶液 |
| C.0.5 mol·L-1鹽酸 | D.0.5 mol·L-1氯化亞鐵和0.5 mol·L-1氯化銅混合溶液 |
(1)鹽酸的濃度(1分);溶液的溫度(1分); 硫酸亞鐵溶液(或其他的亞鐵鹽溶液)(2分);
(2)①(2分) 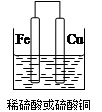
2H+ + 2e- = H2↑ 或Cu2+ + 2e-= Cu (2分)
②D (2分)
(3) 取適量的氯化鋁溶液,用pH試紙測其pH值小于7,則證明氫氧化鋁為弱堿。(2分)
解析試題分析:(1)要驗證Al、Fe、Cu的金屬活動性,除選擇大小相同的金屬片外,還需要控制鹽酸的濃度和溶液的溫度相同,還可以用硫酸亞鐵溶液(或其他的亞鐵鹽溶液)來驗證三種金屬的活潑性;(2)①若用Fe、Cu作電極設計成原電池,則Fe為負極,Cu為正極,可以用稀硫酸或者是硫酸銅為電解質溶液,所以該裝置圖為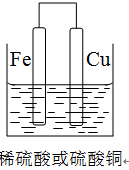 ,若電解質為稀硫酸,則正極反應式為 2H+ + 2e- = H2↑,若電解質溶液為硫酸銅,則正極反應式為Cu2+ + 2e-=" Cu" ;②用Al、Fe作為電極,只用一個原電池證明三種金屬的活動性,則電解質溶液最好選用0.5 mol·L-1氯化亞鐵和0.5 mol·L-1氯化銅混合溶液;(3)可以測定鋁的強酸鹽的pH來判斷,其實驗過程為取適量的氯化鋁溶液,用pH試紙測其pH值小于7,則證明氫氧化鋁為弱堿。
,若電解質為稀硫酸,則正極反應式為 2H+ + 2e- = H2↑,若電解質溶液為硫酸銅,則正極反應式為Cu2+ + 2e-=" Cu" ;②用Al、Fe作為電極,只用一個原電池證明三種金屬的活動性,則電解質溶液最好選用0.5 mol·L-1氯化亞鐵和0.5 mol·L-1氯化銅混合溶液;(3)可以測定鋁的強酸鹽的pH來判斷,其實驗過程為取適量的氯化鋁溶液,用pH試紙測其pH值小于7,則證明氫氧化鋁為弱堿。
考點:原電池,鹽類水解
點評:本題利用原電池的知識來設計實驗比較金屬的活動性,這有利于培養學生的探究性思維,該題難度適中。


科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 某校化學研究性學習小組設計如下實驗方案,測定放置己久的小蘇打樣品中純堿的質量分數.
某校化學研究性學習小組設計如下實驗方案,測定放置己久的小蘇打樣品中純堿的質量分數.查看答案和解析>>
科目:高中化學 來源:2011-2012學年黑龍江哈爾濱市第六中學高三上學期期末考試化學試卷 題型:填空題
(14分)某校化學研究性學習小組設計如下實驗方案,測定放置已久的小蘇打樣品中純堿的質量分數。
(1)方案一:稱取一定質量的樣品,置于坩堝中加熱至恒重后,冷卻,稱量剩余固體質量,計算。實驗中加熱至恒重的目的是 。
(2)方案二:稱取一定量樣品,置于小燒杯中,加適量水溶解,向小燒杯中加入足量氯化鋇溶液,過濾洗滌,干燥沉淀,稱量固體質量,計算:
①過濾操作中,除了燒杯、漏斗外還用到的玻璃儀器有______________________;
②試驗中判斷沉淀是否完全的方法是_______________________________________
③若加入試劑改為氫氧化鋇,已知稱得樣品9.5g,干燥的沉淀質量為19.7g,則樣品中碳酸鈉的質量分數為_________________(保留一位小數)。
查看答案和解析>>
科目:高中化學 來源:2012屆黑龍江哈爾濱市高三上學期期末考試化學試卷 題型:填空題
(14分)某校化學研究性學習小組設計如下實驗方案,測定放置已久的小蘇打樣品中純堿的質量分數。
(1)方案一:稱取一定質量的樣品,置于坩堝中加熱至恒重后,冷卻,稱量剩余固體質量,計算。實驗中加熱至恒重的目的是 。
(2)方案二:稱取一定量樣品,置于小燒杯中,加適量水溶解,向小燒杯中加入足量氯化鋇溶液,過濾洗滌,干燥沉淀,稱量固體質量,計算:
①過濾操作中,除了燒杯、漏斗外還用到的玻璃儀器有______________________;
②試驗中判斷沉淀是否完全的方法是_______________________________________
③若加入試劑改為氫氧化鋇,已知稱得樣品9.5g,干燥的沉淀質量為19.7g,則樣品中碳酸鈉的質量分數為_________________(保留一位小數)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com