
| A. | 溶液中導電粒子的數目增加,導電性增強 | |
| B. | 醋酸的電離程度增大,[H+]減小 | |
| C. | 電離平衡向右移動,電離常數Ka減少 | |
| D. | 稀釋后溶液中由水電離出的[H+]=1×10-11 mol/L |
分析 A.加水稀釋促進醋酸電離,但氫離子和醋酸根離子濃度減小;
B.加水稀釋促進醋酸電離,但氫離子濃度減小;
C.電離常數Ka,是溫度的函數;
D.稀釋后溶液的pH未知,無法計算水電離出氫離子濃度.
解答 解:A.加水稀釋促進醋酸電離,但氫離子和醋酸根離子濃度減小,溶液導電能力與離子濃度成正比,所以溶液導電性減弱,故A錯誤;
B.加水稀釋促進醋酸電離,溶液中氫離子個數增大程度小于溶液體積增大程度,所以氫離子濃度減小,故B正確;
C.電離常數Ka,是溫度的函數,溫度不變電離平衡常數不變,故C錯誤;
D.稀釋后溶液的pH未知,雖然水的離子積常數不變,但無法計算水電離出氫離子濃度,故D錯誤;
故選B.
點評 本題考查了弱電解質的電離,明確弱電解質電離特點是解本題關鍵,加水稀釋促進醋酸電離,但氫離子濃度降低,很多同學往往認為“促進電離,氫離子濃度增大”而導致錯誤,為易錯點.


 黃岡經典趣味課堂系列答案
黃岡經典趣味課堂系列答案 啟東小題作業本系列答案
啟東小題作業本系列答案科目:高中化學 來源: 題型:多選題
| A. | 常溫下,將pH=2的鹽酸和pH=12的氨水等體積混合后:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1 Na2CO3溶液:2c(Na+)=c(HCO3-)+c(CO32?)+c(H2CO3) | |
| C. | 0.1 mol•L-1 NH4Cl溶液:c(NH4+)=c( Cl-) | |
| D. | 向醋酸鈉溶液中加入適量醋酸,得到的酸性混合溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
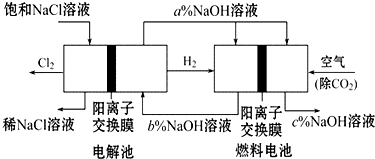 有一種節能的氯堿工業新工藝,將電解池與燃料電池相結合,相關流程如圖(電極未標出).回答下列有關問題:
有一種節能的氯堿工業新工藝,將電解池與燃料電池相結合,相關流程如圖(電極未標出).回答下列有關問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
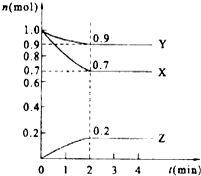 某溫度時,在2L的密閉容器中,X、Y、Z三種物質的量隨時間的變化曲線如圖所示.
某溫度時,在2L的密閉容器中,X、Y、Z三種物質的量隨時間的變化曲線如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 所有的鹽在水溶液中都能水解 | |
| B. | 鹽類水解一定都顯酸性或堿性 | |
| C. | 鹽類的水解反應是酸堿中和反應的逆反應,因此鹽類水解是吸熱反應 | |
| D. | 鹽類水解抑制了水的電離 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 海水中含有鉀元素,只需經過物理變化就可以得到鉀單質 | |
| B. | 海水蒸發制海鹽的過程中發生了化學變化 | |
| C. | 利用潮汐發電是將化學能轉化為電能 | |
| D. | 從海水中可以得到NaCl,電解熔融NaCl可制備金屬鈉 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:1 | B. | 2:3 | C. | 3:4 | D. | 4:3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com