
【題目】溶解氧(指溶解在水體中氧氣分子)是衡量水質的一個重要指標。為測定某水樣中溶解氧含量(ρ=![]() )設計了如下實驗方案。實驗步驟如下:
)設計了如下實驗方案。實驗步驟如下:
步驟1:水樣的采集與固定
用水樣瓶準確量取100mL的待測水樣(不能留有氣泡),并用針筒向水樣下方快速注入2.0mLMnSO4溶液和3.0mL堿性KI溶液,蓋好瓶蓋,上下顛倒搖勻,此時生成Mn2+在堿性條件下被水中的氧氣氧化為MnOOH棕色沉淀,靜置至澄清。
步驟2:碘的游離
向水樣瓶中加入3.0mL濃硫酸,使I-在酸性條件下被MnOOH氧化為I2,同時MnOOH被還原Mn2+,待沉淀完全溶解后,將它們全部轉移到250mL錐形瓶中。
步驟3:碘的滴定
向錐形瓶中加入少量淀粉溶液,再滴加0.005mol·L-1的Na2S2O3標準溶液,恰好完全反應時,消耗Na2S2O3標準溶液的體積為16mL。(已知:I2+2S2O32-=2I-+S4O62-)
(1)MnOOH中Mn元素的化合價是___。
(2)寫出步驟2中所發生反應的離子方程式___。
(3)若待測水樣中留有氣泡,則測定結果將___。(填“偏大”、“偏小”或“無影響”)
(4)計算該水樣中溶解氧的含量ρ(以mg·L-1表示),并寫出計算過程:___。
【答案】+3 2I-+2MnOOH+6H+=I2+2Mn2++4H2O 偏大 6.4mg·L-1
【解析】
該實驗利用Mn2+在堿性條件下被水中的氧氣氧化為MnOOH棕色沉淀,然后加入濃硫酸,使I-在酸性條件下被MnOOH氧化為I2,然后利用Na2S2O3標準溶液進行滴定,通過消耗的Na2S2O3標準溶液的量計算水中溶解氧的含量,以此進行分析。
(1)MnOOH中O呈-2價,H呈+1價,根據化合物化合價為0可知Mn元素的化合價為+3價;
(2)步驟2為酸性條件下I-與MnOOH發生氧化還原反應,I元素化合價從-1價升高為0價,Mn元素化合價從+3價降低為+2價,根據氧化還原反應得失電子守恒、電荷守恒、原子守恒可知其離子方程式為:2I-+2MnOOH+6H+=I2+2Mn2++4H2O;
(3)若待測液中含有水泡,即含有未溶解的氧氣,則消耗的MnSO4增加,后續生成的I2會增加,最終滴定消耗的Na2S2O3標準溶液增加,最終測得的結果將偏大;
(4)整個過程中Mn2+反應前后未發生變化,根據整個得失電子守恒可列出關系式:
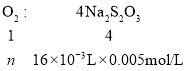
解得n(O2)=2×10-5mol,水樣中溶解氧含量ρ=![]() =6.4mg·L-1。
=6.4mg·L-1。


科目:高中化學 來源: 題型:
【題目】鐵的氧化物可用于脫除煤氣中的H2S,有一步反應為:Fe3O4(s)+3H2S(g)+H2(g)![]() 3 FeS(s)+4 H2O(g),其溫度與平衡常數的關系如圖所示。對此反應原理的理解正確的是
3 FeS(s)+4 H2O(g),其溫度與平衡常數的關系如圖所示。對此反應原理的理解正確的是
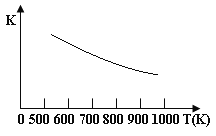
A.H2S是還原劑
B.脫除H2S的反應是放熱反應
C.溫度越高H2S的脫除率越大
D.壓強越小H2S的脫除率越高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】疊氮化鈉用于汽車的安全氣囊中,當發生車禍時迅速分解放出氮氣,使安全氣囊充氣,其與酸反應可生成氫疊氮酸(HN3),常用于引爆劑,氫疊氮酸還可由肼(N2H4)制得。下列敘述錯誤的是
A.CO2、N2O與N3-互為等電子體
B.氫疊氮酸(HN3)和水能形成分子間氫鍵
C.NaN3的晶格能小于 KN3的晶格能
D.HN3和 N2H4都是由極性鍵和非極性鍵構成的非極性分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】新型超高能材料是國家核心軍事力量制高點的重要標志,高性能炸藥BNCP的結構如圖,回答下列問題:
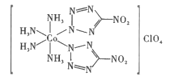
(1)BNCP中Co3+的基態價層電子軌道表示式是__,Co3+的配位數是__,陰離子ClO4-的中心原子雜化類型是__。
(2)1mol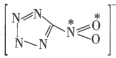 配體中的σ鍵的數目是__,已知該配體是平面結構,圖中標記的N原子與O原子之間的σ鍵是由N原子的__雜化軌道與O原子的__軌道重疊形成的。
配體中的σ鍵的數目是__,已知該配體是平面結構,圖中標記的N原子與O原子之間的σ鍵是由N原子的__雜化軌道與O原子的__軌道重疊形成的。
(3)比較NO2+、NO2、NO2-的鍵角大小:__,與NO2-互為等電子體的單質是___。
(4)比較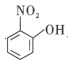 、
、![]() 的沸點并說明理由:__。
的沸點并說明理由:__。
(5)比較H2O與OF2的極性大小并說明理由:__。
(6)2018年南京理工大學胡炳成團隊合成全國首個全氮陰離子,全氮陰離子的鹽AgN5的晶體結構中:N5-采取面心立方最密堆積,Ag+填在正四面體空隙中,從晶胞上方的俯視投影圖如圖。每個晶胞中含有的N5-的數目是__。Ag+與N5-最近的距離是__(用a表示)。
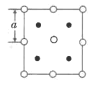
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在指定溶液能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水電離的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】濃度、溫度、壓強、催化劑對化學反應速率有影響,合成氨反應N2+3H2![]() 2NH3,在其他條件不變時,改變下列條件對化學反應速率影響不正確的是( )
2NH3,在其他條件不變時,改變下列條件對化學反應速率影響不正確的是( )
A.增大N2或H2的濃度,達到化學平衡時,正反應速率增大,逆反應速率減小
B.升高溫度正、逆反應速率均增大
C.減小壓強正、逆反應速率均小
D.加入正催化劑,縮短達到化學平衡所需要的時間
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二茂鐵[Fe(C5H5)2]可作為燃料的節能消煙劑、抗爆劑。二茂鐵的電化學制備裝置與原理如圖所示,下列說法正確的是
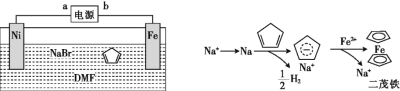
A.a為電源的負極
B.電解質溶液是NaBr水溶液和DMF溶液的混合液
C.電解池的總反應化學方程式為Fe+2C5H6![]() Fe(C5H5)2+H2↑
Fe(C5H5)2+H2↑
D.二茂鐵制備過程中陰極的電極反應為2H++2e-![]() H2 ↑
H2 ↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某無色溶液![]() 中,可能含有
中,可能含有![]() 中的一種或幾種。現取該溶液適量,向其中加入一定物質的量濃度的稀鹽酸,產生沉淀的物質的量(n)與加入鹽酸的體積(V)的關系如圖所示。下列說法中不正確的是( )
中的一種或幾種。現取該溶液適量,向其中加入一定物質的量濃度的稀鹽酸,產生沉淀的物質的量(n)與加入鹽酸的體積(V)的關系如圖所示。下列說法中不正確的是( )
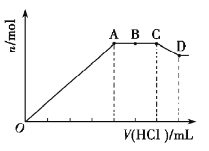
A.溶液![]() 中一定不含
中一定不含![]() ,可能含有
,可能含有![]()
B.![]() 段參加反應的陰離子的物質的量之比為
段參加反應的陰離子的物質的量之比為![]() 或
或![]()
C.![]() 段一定生成了氣態物質
段一定生成了氣態物質
D.![]() 段發生反應的離子方程式為:
段發生反應的離子方程式為:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷化硼是一種超硬耐磨涂層材料,右圖為其晶胞,其中的每個原子均滿足8電子穩定結構。下列有關說法正確的是( )

A. 磷化硼晶體中每個原子均形成4條共價鍵
B. 磷化硼晶體的化學式為BP,屬于離子晶體
C. 磷化硼晶體的熔點很低
D. 磷化硼晶體結構中微粒的空間堆積方式與氯化鈉晶體相同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com