
【題目】工業上用鋁土礦(主要成分為Al2O3,含Fe2O3雜質)為原料冶煉鋁的工藝流程如圖所示:
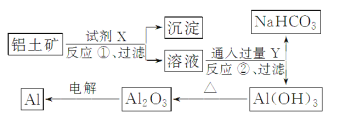
下列敘述正確的是
A. 試劑X可以是NaOH溶液,也可以是鹽酸
B. 反應①過濾后所得沉淀為Fe(OH)3
C. 圖中所有轉化反應都不是氧化還原反應
D. 反應②的化學方程式為Na[Al(OH)4]+CO2===Al(OH)3↓+NaHCO3
【答案】D
【解析】
由于Al2O3屬于兩性氧化物,而Fe2O3屬于堿性氧化物,所以應選用氫氧化鈉溶液溶解Al2O3;
由溶液乙通入過量的Y生成氫氧化鋁沉淀、碳酸氫鈉可知,溶液乙中含有偏鋁酸根、氣體Y為二氧化碳;流程最后一步電解Al2O3制取Al時,屬于氧化還原反應;過量的二氧化碳與偏鋁酸鈉反應生成氫氧化鋁沉淀與碳酸氫鈉,據此可解題。
A、由溶液乙通入過量的Y生成氫氧化鋁沉淀、碳酸氫鈉可知,溶液乙中含有偏鋁酸根、氣體Y為二氧化碳,故試劑X為氫氧化鈉溶液,不可能為鹽酸,故A錯誤;
B、氧化鐵與氫氧化鈉不反應,反應①后過濾所帶沉淀為氧化鐵,故B錯誤;
C、電解熔融氧化鋁生成鋁時,元素化合價發生變化屬于氧化還原反應,故C錯誤;
D、過量的二氧化碳與偏鋁酸鈉反應生成氫氧化鋁沉淀與碳酸氫鈉,反應方程式為Na[Al(OH)4]+CO2===Al(OH)3↓+NaHCO3,故D正確。
故選D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案 目標測試系列答案
目標測試系列答案科目:高中化學 來源: 題型:
【題目】鋁是重要的金屬材料,鋁土礦(主要成分是Al2O3和少量的SiO2、Fe2O3雜質)是工業上制取鋁的原料。實驗室模擬工業上以鋁土礦為原料制取Al2(SO4)3和銨明礬晶體[NH4Al(SO4)2·12H2O]的工藝流程如圖所示:
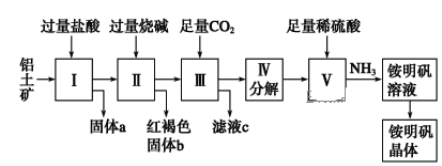
請回答下列問題:
(1)固體a的化學式為________。
(2)寫出Ⅱ中加過量的燒堿涉及到的反應離子方程式______________、_____________;Ⅲ中通入足量CO2氣體發生反應的離子方程式為_________________。
(3)由Ⅲ中得到濾液c的實驗操作為__________,從銨明礬溶液中獲得銨明礬晶體的實驗操作依次為(填操作名稱)________、冷卻結晶、過濾洗滌。
(4)濾液c顯________性,日常生活中常用其溶質來________________(任寫一點);
(5)向銨明礬NH4Al(SO4)2中加氫氧化鋇使硫酸根離子完全沉淀化學方程式為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列是某蛋白質的結構片段:

(1)上述蛋白質的結構片段的水解產物中不屬于α氨基酸的結構簡式是_____________________。
(2)上述蛋白質的結構片段水解后的氨基酸中,某氨基酸中碳、氫原子數比值最大。
①該氨基酸與NaOH反應的化學方程式為________________________。
②該氨基酸二分子縮合形成環狀物質的分子式為_______________。
③該氨基酸的同分異構體中,屬于硝基化合物且苯環上除硝基外只有甲基的同分異構體有________種。
(3)已知上述蛋白質結構片段的式量為364,則水解成的各氨基酸的式量之和為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】0.1mol/L的CH3COOH溶液加水稀釋或升高溫度的過程中,下列表達式的數值一定變大的是( )
A. c(H+) B. c(H+)·c(OH-) C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列遞變規律正確的是( )
A. HClO4、H2SO4、H3PO4的酸性依次增強 B. 鈉、鎂、鋁的還原性依次減弱
C. HCl、HBr、HI的穩定性依次增強 D. P、S、Cl原子半徑逐漸增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】輝銅礦石主要含有硫化亞銅(Cu2S)及少量脈石(SiO2)。一種以輝銅礦石為原料制備硝酸銅的工藝流程如下所示:
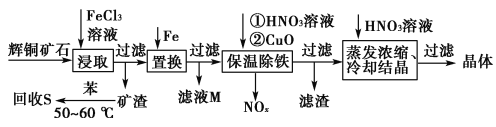
(1)寫出“浸取”過程中Cu2S溶解時發生反應的離子方程式:______________________________________________________________。
(2)“回收S”過程中溫度控制在50~60 ℃之間,不宜過高或過低的原因是______________________________________________________________。
(3)氣體NOx與氧氣混合后通入水中能生成流程中可循環利用的一種物質,該反應的化學方程式為_________________________________________________;
向濾液M中加入(或通入)________(填字母),可得到另一種可循環利用的物質。
a.鐵 b.氯氣 c.高錳酸鉀
(4)“保溫除鐵”過程中,加入CuO的目的是__________;“蒸發濃縮、冷卻結晶”過程中,要用HNO3溶液調節溶液的pH,其理由____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、X、W、D、E為短周期元素,且原子序數依次增大。A、D同主族,X、W同周期, X形成的氣態氫化物可使濕潤的紅色石蕊試紙變藍, A、W能形成兩種液態化合物A2W和A2W2,E元素的周期序數與主族序數相等。
(1)W的原子結構示意圖為________。
(2)A、W兩種元素能形成含18電子的分子,請寫出該分子的電子式:_______________。用電子式表示化合物D2W的形成過程______________________。
(3)下列事實能說明W元素的非金屬性比S元素的非金屬性強的是________ (填字母)。
a.W單質與H2S溶液反應,溶液變渾濁
b.在氧化還原反應中,1 mol W單質比1 mol S得電子多
c.W和S兩元素的簡單氫化物受熱分解,前者的分解溫度高
(4)X的最高價氧化物對應水化物與其簡單氣態氫化物所形成的化合物中含有的化學鍵類型是_______
(5)廢印刷電路板上含有銅,以往的回收方法是將其灼燒使銅轉化為氧化銅,再用硫酸溶解。現在改用A2W2和稀硫酸浸泡廢印刷電路板既達到上述目的,又保護了環境,試寫出反應的離子方程式________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某烯烴A,分子式為C8H16,A在一定條件下被氧化只生成一種物質B,B能與純堿反應。已知:
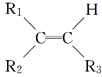
![]()
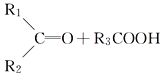
則符合上述條件的烴A有________種(不考慮順反異構)( )
A. 2 B. 3 C. 4 D. 5
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com