
 現有五種元素,其中A、B、C為短周期主族元素,D、E為第四周期元素,它們的原子序數依次增大.請根據表中相關信息,回答問題.
現有五種元素,其中A、B、C為短周期主族元素,D、E為第四周期元素,它們的原子序數依次增大.請根據表中相關信息,回答問題.| A元素原子的核外p電子總數比s電子總數少1 |
| B原子核外所有p軌道全滿或半滿 |
| C元素的主族序數與周期數的差為4 |
| D是前四周期中電負性最小的元素 |
| E在周期表的第十一列 |
分析 A、B、C為短周期主族元素,D、E為第四周期元素,它們的原子序數依次增大,A元素原子的核外p電子數比s電子數少1,其電子排布為:1s22s22p3,則A為N元素;B原子核外所有p軌道全滿或半滿,則價電子為3s23p3符號題意,則B為P元素;C元素的主族序數與周期數的差為4,C為第三周期第ⅤⅡA族元素,即C為Cl元素;D、E為第四周期元素,它們的原子序數依次增大,D是前四周期中電負性最小的元素,則D為K元素;E在周期表的第11列,則E位于第四周期第IB族,為Cu元素,然后利用原子結構及分子的空間構型來解答.
解答 解:A、B、C為短周期主族元素,D、E為第四周期元素,它們的原子序數依次增大,A元素原子的核外p電子數比s電子數少1,其電子排布為:1s22s22p3,則A為N元素;B原子核外所有p軌道全滿或半滿,則價電子為3s23p3符號題意,則B為P元素;C元素的主族序數與周期數的差為4,C為第三周期第ⅤⅡA族元素,即C為Cl元素;D、E為第四周期元素,它們的原子序數依次增大,D是前四周期中電負性最小的元素,則D為K元素;E在周期表的第11列,則E位于第四周期第IB,為Cu元素,
(1)A為N元素,N的基態原子中能量最高的電子為2p電子,其電子云在空間有x、y、z三個方向;p軌道呈紡錘形,
故答案為:3;紡錘形;
(2)E為Cu原子,原子序數為29,位于周期表中第四周期第IB族,位于周期表中的ds區,銅原子的核外電子總數為29,所以其基態原子有29種不同的運動狀態,
故答案為:第四周期第IB族;ds;29;
(3)BC3為PCl3,其中心原子P形成了3個單鍵,還存在1對孤對電子,則其雜化軌道數為4,采用sp3;由于三氯化磷分子中含有1對孤對電子,則其空間構型為三角錐形;D為K元素,檢驗鉀元素可以通過焰色反應檢驗,
故答案為:sp3;三角錐形;焰色反應;
(4)E為Cu元素,由晶胞結構可知,以頂點原子研究,與之最近的原子處于面心上,每個頂點原子為12個面共用,故晶胞中該原子的配位數為12;該單質晶體中原子的堆積方式為面心立方堆積,結合乙圖可知,晶胞的邊長為$\frac{\sqrt{2}}{2}$×4dcm=2$\sqrt{2}$dcm,所以晶胞的體積為(2$\sqrt{2}$dcm)3=16$\sqrt{2}$d3cm3,根據均攤法可知,每個晶胞中含有的原子數為8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以晶胞的密度為:$\frac{\frac{4×M}{{N}_{A}}g}{16\sqrt{2}p9vv5xb5^{3}c{m}^{3}}$=$\frac{M}{4\sqrt{2}p9vv5xb5^{3}{N}_{A}}$g•cm-3,
故答案為:12;面心立方堆積;$\frac{M}{4\sqrt{2}p9vv5xb5^{3}{N}_{A}}$.
點評 本題考查位置、結構、性質的關系及其應用,題目難度較大,推斷各元素為解答關鍵,注意熟練掌握原子結構與元素周期表、元素周期律的關系,(4)為難點,注意掌握晶胞計算的方法與技巧.


 高效智能課時作業系列答案
高效智能課時作業系列答案 捷徑訓練檢測卷系列答案
捷徑訓練檢測卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 14.2% | B. | 16% | C. | 17.8% | D. | 19.4% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
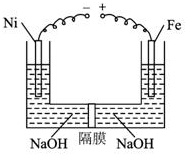 近年來研究表明高鐵酸鹽在能源、環境保護等方面有著廣泛的用途.我國學者提出在濃NaOH溶液中用電化學方法來制備高鐵酸鹽[FeO42-],電解裝置如圖.下列說法中不正確的是( )
近年來研究表明高鐵酸鹽在能源、環境保護等方面有著廣泛的用途.我國學者提出在濃NaOH溶液中用電化學方法來制備高鐵酸鹽[FeO42-],電解裝置如圖.下列說法中不正確的是( )| A. | 鉛蓄電池是一種二次電池 | |
| B. | 電解時,陽極區溶液的PH不變 | |
| C. | 當陰極收集到0.15mol氣體時,可獲得0.05molNa2FeO4 | |
| D. | 當陰極收集到0.15mol氣體時,鉛蓄電池中消耗0.3molH2SO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
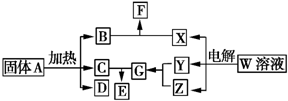 如圖所示的無機物的轉化關系中,部分生成物和反應條件已略去.其中A與F是兩種酸式鹽;常溫下B、C、Y、Z是氣體,且B能使Z的水溶液褪色;E是一種常見的化肥;X中含有20個電子.
如圖所示的無機物的轉化關系中,部分生成物和反應條件已略去.其中A與F是兩種酸式鹽;常溫下B、C、Y、Z是氣體,且B能使Z的水溶液褪色;E是一種常見的化肥;X中含有20個電子. ;E中含有的化學鍵類型是離子鍵和共價鍵.
;E中含有的化學鍵類型是離子鍵和共價鍵.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 為擺脫對石油的過度依賴,科研人員將煤液化制備汽油,并設計了汽油燃料電池,電池工作原理如圖所示:一個電極通入氧氣,另一電極通入汽油蒸氣,電解質是摻雜了Y2O3的ZrO2晶體,它在高溫下能傳導O2-.
為擺脫對石油的過度依賴,科研人員將煤液化制備汽油,并設計了汽油燃料電池,電池工作原理如圖所示:一個電極通入氧氣,另一電極通入汽油蒸氣,電解質是摻雜了Y2O3的ZrO2晶體,它在高溫下能傳導O2-.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
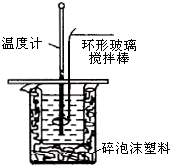 利用如圖裝置測定中和熱的實驗步驟如下:
利用如圖裝置測定中和熱的實驗步驟如下:| 溫度 實驗次數 | 起始溫度t1/℃ | 終止溫度 t2/℃ | 溫度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 應用 | 解釋 |
| A | 高純硅作計算機芯片的材料 | 硅晶體在自然界中能穩定存在 |
| B | 在入海口的鋼鐵閘門上裝一定數量的鋅塊防止閘門被腐蝕 | 利用外加電流的陰極保護法保護金屬 |
| C | 高鐵車廂采用鋁合金材料 | 鋁合金強度大,質量輕,不與氧氣反應 |
| D | 用浸泡過高錳酸鉀溶液的硅藻土保鮮水果 | 其作用是吸收水果釋放出的乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com