
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 電離平衡常數 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等物質的量濃度溶液的pH關系為pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol•L-1HCN溶液與b mol•L-1NaOH溶液等體積混合后,所得溶液中:c(Na+)>c(CN-),則a一定小于b | |
| C. | 往冰醋酸中逐滴加水,溶液的導電性逐漸增大 | |
| D. | 將0.2 mol•L-1 KHCO3溶液與0.1 mol•L-1 KOH溶液等體積混合:c(K+)+c(H+)=c(OH-)+c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$) |
分析 A.酸的電離平衡常數越大,酸根離子水解程度越小,相同濃度的鈉鹽溶液pH越小;
B.HCN與NaOH恰好反應生成NaCN,CN-發生水解濃度減小;
C.溶液導電能力與離子濃度成正比;
D.0.2 mol•L-1 KHCO3溶液與0.1 mol•L-1 KOH溶液等體積混合生成K2CO3,KHCO3有剩余,根據電荷守恒分析.
解答 解:A.酸的電離平衡常數越大,酸根離子水解程度越小,相同濃度的鈉鹽溶液pH越小,水解程度CO32->CN->CH3COO-,則這三種鹽pH大小順序是pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故A錯誤;
B.HCN與NaOH恰好反應生成NaCN,CN-發生水解濃度減小,所以NaCN溶液中c(Na+)>c(CN-),此時a=b,故B錯誤;
C.溶液導電能力與離子濃度成正比,稀釋過程中促進醋酸電離,溶液中離子濃度 先增大后減小,所以溶液導電能力先增大后減小,故C錯誤;
D.0.2 mol•L-1 KHCO3溶液與0.1 mol•L-1 KOH溶液等體積混合生成K2CO3,KHCO3有剩余,溶液中的電荷守恒為:c(K+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D正確;
故選D.
點評 本題考查了弱電解質的電離及鹽類水解,明確酸的強弱與酸根離子水解程度關系是解本題關鍵,注意:溶液導電能力與離子濃度成正比,與電解質強弱無關,易錯選項是C.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2在Cl2中劇烈燃燒,發出黃色火焰,冒白煙 | |
| B. | SiO2的化學性質不活潑,不與任何酸發生反應 | |
| C. | 常溫下,鋁、鐵遇濃硫酸會發生鈍化反應 | |
| D. | 將氯氣通入紫色石蕊試液中一些時間后,溶液變紅 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A~I為中學化學中常見的物質,B、E、F為單質,且在常溫下B是一種黃綠色有毒氣體,E為紫紅色金屬,G為黑色固體.它們的相互轉化關系如圖所示(部分生成物未列出).請回答下列問題:
A~I為中學化學中常見的物質,B、E、F為單質,且在常溫下B是一種黃綠色有毒氣體,E為紫紅色金屬,G為黑色固體.它們的相互轉化關系如圖所示(部分生成物未列出).請回答下列問題: .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
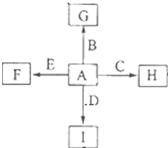 如圖中,A、B、C、D、E是單質,G、H、I、F是B、C、D、E分別和A形成的二元化合物,已知:
如圖中,A、B、C、D、E是單質,G、H、I、F是B、C、D、E分別和A形成的二元化合物,已知:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
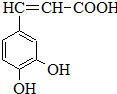 咖啡酸(如圖),存在于許多中藥中,如野胡蘿卜、光葉水蘇、蕎麥、木半夏等.咖啡酸有止血作用,特別對內臟的止血效果較好.
咖啡酸(如圖),存在于許多中藥中,如野胡蘿卜、光葉水蘇、蕎麥、木半夏等.咖啡酸有止血作用,特別對內臟的止血效果較好.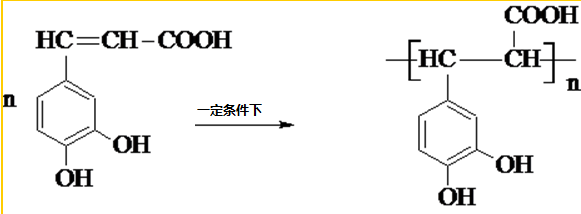 .
.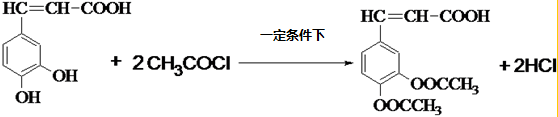 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com