
【題目】基于CaSO4為載氧體的天然氣燃燒是一種新型綠色的燃燒方式,CaSO4作為氧和熱量的有效載體,能夠高效低能耗地實現CO2的分離和捕獲其原理如下圖所示:
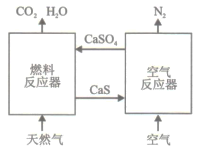
(1)已知在燃料反應器中發生如下反應:
i.4CaSO4(s)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反應器中主反應為_________(填“i”“ii”或“ⅲ”)。
②反應i和ii的平衡常數Kp與溫度的關系如圖1,則a_______0(填“ >”“ =“或“<” );720℃時反應ⅲ的平衡常數Kp=________。

③下列措施可提高反應ii中甲烷平衡轉化率的是_______。
A.增加CaSO4固體的投入量 B.將水蒸氣冷凝
C.降溫 D.增大甲烷流量
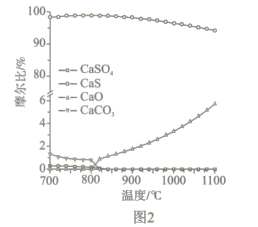
(2)如圖2所示,該燃料反應器最佳溫度范圍為850℃ -900℃之間,從化學反應原理的角度說明原因:_______。
(3)空氣反應器中發生的反應為
CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根據熱化學原理推測該反應為__________反應。
②在天然氣燃燒過程中,可循環利用的物質為________。
(4)該原理總反應的熱化學方程式為____________
【答案】 ii > 1.0×10-18 B 溫度過低,反應速率較慢 ;溫度較高,副反應增多 放熱 CaS、CaSO4 CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=(b+d)kJ/mol或ΔH=(a-c+d)kJ/mol
【解析】(1)①由圖示可得,天然氣和CaSO4進入燃料反應器,反應生成CaS、CO2和H2O,故燃料反應器中主反應為ii。②由圖1可看出,溫度越高lgKp越大,即升溫Kp增大,故反應i和反應ii都是吸熱反應,則a和b都大于0。設三個反應的平衡常數Kp分別為:Kpi、Kpii、Kpⅲ,根據蓋斯定律,i-ii得ⅲ,所以Kpⅲ=![]() ;由圖并結合熱化學方程式可得720℃時反應i的lgKp為:-2×4=-8,反應ii的lgKp為10,所以Kpi=10-8,Kpii=1010,故Kpⅲ=
;由圖并結合熱化學方程式可得720℃時反應i的lgKp為:-2×4=-8,反應ii的lgKp為10,所以Kpi=10-8,Kpii=1010,故Kpⅲ=![]() =
=![]() =1.0×10-18。③A項,增加固體物質的投入量,不改變化學平衡,所以增加CaSO4固體的投入量不能提高反應ii中甲烷平衡轉化率,故A錯誤;B項,將生成物分離出去能使化學平衡正向移動,所以將水蒸氣冷凝能提高反應ii中甲烷平衡轉化率,故B正確;C項,通過②的分析,該反應為吸熱反應,降溫能降低反應ii中甲烷平衡轉化率,故C錯誤;D項,增大甲烷流量,增大了甲烷的濃度,平衡正向移動,但根據勒沙特列原理,甲烷平衡轉化率會降低,故D錯誤。
=1.0×10-18。③A項,增加固體物質的投入量,不改變化學平衡,所以增加CaSO4固體的投入量不能提高反應ii中甲烷平衡轉化率,故A錯誤;B項,將生成物分離出去能使化學平衡正向移動,所以將水蒸氣冷凝能提高反應ii中甲烷平衡轉化率,故B正確;C項,通過②的分析,該反應為吸熱反應,降溫能降低反應ii中甲烷平衡轉化率,故C錯誤;D項,增大甲烷流量,增大了甲烷的濃度,平衡正向移動,但根據勒沙特列原理,甲烷平衡轉化率會降低,故D錯誤。
(2)從反應速率角度考慮,溫度過低,反應速率較慢,應在較高溫度下反應,但由圖2可得,溫度越高,副反應增多,所以該燃料反應器最佳溫度范圍為850℃~900℃之間。
(3)①由方程式可看出該反應S<0,因為自發反應H-TS<0,所以H<0,故該反應為放熱反應。②空氣反應器中CaS和O2反應生成CaSO4,燃料反應器中,天然氣和CaSO4反應生成CaS、CO2和H2O,所以在天然氣燃燒過程中可循環利用的物質為:CaS和CaSO4。
(4)將反應CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol標號為iiii,分析空氣反應器中發生的反應和燃料反應器中發生的反應,根據蓋斯定律,ii+iiii或i-iii+iiii得該原理總反應的熱化學方程式為:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=(b+d)kJ/mol或ΔH=(a-c+d)kJ/mol。


科目:高中化學 來源: 題型:
【題目】已知水在25℃和95℃時,其電離平衡曲線如右圖所示:

(1)則25℃時水的電離平衡曲線應為__________(填“A”或“B”);
(2)25℃時,將![]() =11的NaOH溶液與
=11的NaOH溶液與![]() =4的
=4的![]() 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的![]() =9,則NaOH溶液與
=9,則NaOH溶液與![]() 溶液的體積比為____________;
溶液的體積比為____________;
(3)95℃時,若100體積![]() 1=
1=![]() 的某強酸溶液與1體積
的某強酸溶液與1體積![]() 2=b的某強堿溶液混合后溶液呈中性,則混合前,該強酸的
2=b的某強堿溶液混合后溶液呈中性,則混合前,該強酸的![]() 1與強堿的
1與強堿的![]() 2之間應滿足的關系是_______。
2之間應滿足的關系是_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某硫酸工業廢渣的主要成分為SiO2、MgO、Al2O3、Fe2O3等。回收廢渣中金屬元素的工藝流程如下:

已知常溫條件下:
①陽離子以氫氧化物形式開始沉淀和恰好完全沉淀(陽離子濃度等于10-5mol·L-1 )時的pH 如下表所
示。
陽離子 | Fe3+ | Al3+ | Mg2+ |
開始沉淀時的pH | 1.9 | 3.7 | 9.6 |
恰好完全沉淀時的pH | 3.2 | 5.2 | 11.0 |
②飽和氨水溶液中c(OH-)約為1×10-3mol·L-1。
請回答下列問題:
(1)固體C為_________(填化學式)。
(2)上述流程中兩次使用試劑X,試劑X是_________(填“氨水”或“氫氧化鈉”),其理由是_________________。
(3)溶液D→固體E的過程中需要控制溶液pH=13,如果pH過小,可能導致的后果是________________。
(4)寫出溶液F→溶液H 的離子方程式:__________________。
(5)Ksp[Mg (OH )2]=_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】《本草綱目》曾記載利尿劑甘汞(Hg2Cl2)制法:"用水銀一兩,白礬[KAl(SO4)2]二兩,食鹽一兩,同研,不見星。鋪于器內,以小烏盆覆之,篩灶灰,鹽水和,封固盤口,以炭打二柱香取開,則粉升于盆上矣,其白如雪,輕盈可愛,一兩汞可升粉八錢。”
(1)甘汞(Hg2Cl2)中化學鍵類型主要為___________.
(2)[KAl(SO4)2]所屬物質類別為__________ (填標號)
A.酸式鹽 B.復鹽 C.正鹽 D.混鹽 E.硫酸鹽
(3)文中“同研”涉及的操作,若在實驗室通風櫥內完成,則所需的儀器是_______。
(4)文中“則粉升于盆上矣”涉及的混合物分離方法是__________
(5)甘汞(Hg2Cl2)制備反應中,氧化劑與還原劑的物質的量之比為_________,該反應中還原產物是__________。
(6)已知文中一兩等于十錢,則甘汞的產率約為________(保留三位有效數字)。
(7)由甘汞(Hg2Cl2)光照可得外科用藥升汞(HgCl2),該反應化學方程式為___________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁錳合金可作煉鋼脫氧劑。某課外小組欲測定鋁錳合金中錳的含量。
I硫酸亞鐵銨[(NH4)2Fe(SO4)2]溶液的濃度滴定
步驟1:取20.00mL 0.015mol/L K2Cr2O7標準液于250mL錐形瓶中,加入20mL稀硫酸和5mL濃磷酸,用硫酸亞鐵銨溶液滴定,接近終點時加2滴R溶液作指示劑,繼續滴定至終點,消耗的體積為V1mL。
步驟2:重復步驟1實驗,接近終點時加4滴R溶液,消耗的體積為V2mL.
Ⅱ過硫酸銨[(NH4)2S2O8]催化氧化滴定法測定錳含量
取mg鋁錳合金于錐形瓶中,加入適量的濃磷酸,加熱至完全溶解,稀釋冷卻謠勻,再加入少量的硝酸銀溶液、過量的過硫酸銨溶液,加熱煮沸至無大量氣泡冒出,冷卻至室溫(此時溶液中錳的化合價為+7),用標定的硫酸亞鐵銨溶液進行滴定,根據實驗數據計算鋁錳合金中錳的含量。
[查閱資料]①酸性條件下,Cr2O72-具有很強的氧化性,易被還原為綠色的Cr3+;
②R溶液的變色原理: ![]()
(1)Ⅰ中步驟1.2需要的玻璃儀器有錐形瓶、膠頭滴管,_______、________。
(2)Ⅰ中滴定過程,主要反應的離子方程式是________。
(3)Ⅰ中步驟2的主要作用是_________
(4)Ⅱ中硫酸亞鐵銨溶液的滴定濃度是_________mol/L (用含V1、V2的代數式表示)。
(5)Ⅱ中加入硝酸銀溶液的目的是________。
(6)Ⅱ中若未加熱煮沸無大量氣泡冒出,錳含量測定結果將_______(填“偏大”“偏小”或“無影響”)。
(7)為了提高該實驗的準確度和可靠度,需進行________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】N2O和CO是環境污染性氣體,可在Pt2O+表面轉化為無害氣體,其反應為N2O(g)+CO(g) CO2(g)+N2(g) △H,有關化學反應的物質變化過程(圖1)及能量變化過程(圖2)如下:

下列說法正確的是( )
A.由圖1可知:△H1=△H+△H2
B.由圖2可知△H =-226 kJ/mol
C.為了實現轉化需不斷向反應器中補充Pt2O+和Pt2O2+
D.由圖2可知該反應正反應的活化能大于逆反應的活化能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A 氣體為直線型分子;B、C氣體在標況下的密度均為1.25g/L;反應①②反應機理類似且原子利用率均為 100%;請回答下列問題:
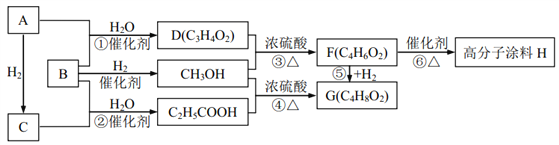
(1)D 中含有的官能團的名稱為________________________;
(2)高分子涂料 H 的結構簡式為________________________;
(3)下列說法正確的是(___)
A.鑒別有機物 A、 C 可以選用溴的四氯化碳溶液,褪色的是 A
B.反應⑤既是加成反應,又是還原反應,而且原子利用率為 100%
C.高分子涂料 H 含有碳碳雙鍵,所以可以使酸性高錳酸鉀溶液褪色
D.反應③④中濃硫酸的作用為催化劑和吸水劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)下圖的虛線框中每一列、每一行相當于課本附錄的元素周期表的每一族和每一周期,并已標出氫元素的位置,但它的列數和行數都多于元素周期表。請在虛線框中用實線畫出周期表第一至第五周期的輪廓,并畫出金屬與非金屬的分界線________。

(2)部分短周期主族元素的原子半徑及主要化合價
元素 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 | 庚 | 辛 |
原子半徑(nm) | 0.077 | 0.143 | 0.111 | 0.104 | 0.066 | 0.186 | 0.037 | 0.099 |
主要化合價 | +4,-4 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
①乙元素的原子結構示意圖____________,丙在元素周期表中的位置___________,戊、庚、辛以原子個數比1∶1∶1形成的化合物的結構式______________。
②甲的單質與丁的最高價氧化物的水化物反應的化學方程式是___________,辛的單質與己的最高價氧化物的水化物反應的離子方程式是______________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com