
| 氫氧化物開始沉淀時的pH | 氫氧化物沉淀完全時的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7.0 | 9.0 |
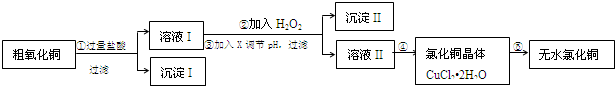
分析 粗CuO中含有FeO和不溶于酸的雜質,將粗CuO溶于過量鹽酸,發生的反應有FeO+2HCl=FeCl2+H2O、CuO+2HCl=CuCl2+H2O,然后過濾,得到沉淀I為不溶于酸的雜質,溶液I中溶質為FeCl2、CuCl2和HCl,向溶液I中加入X、Y然后調節pH過濾,得到沉淀II,溶液II,除去FeCl2、CuCl2和HCl中的FeCl2,根據氫氧化物沉淀需要的pH知,應該先將FeCl2氧化為鐵鹽,為不引進新的雜質,氧化劑X應該為Cl2或H2O2,然后向溶液中加入CuO調節溶液的pH,所以Y可以是CuO,則沉淀II為Fe(OH)3,然后將溶液II蒸發濃縮、冷卻結晶得到CuCl2.2H2O,最后在HCl氛圍中加熱CuCl2.2H2O得到CuCl2;
(1)堿性氧化物和酸反應生成鹽和水;
(2)步驟②加入氧化劑將亞鐵離子氧化生成鐵離子,然后調節溶液的pH除去鐵離子;
(3)當鐵離子完全沉淀時溶液的pH為3.2,當銅離子出現沉淀時溶液的pH為4.7,調節溶液的pH要除去鐵離子而不能除去銅離子.
(4)氯化氫抑制氯化銅的水解,以便達到氯化銅晶體.
解答 解:粗CuO中含有FeO和不溶于酸的雜質,將粗CuO溶于過量鹽酸,發生的反應有FeO+2HCl=FeCl2+H2O、CuO+2HCl=CuCl2+H2O,然后過濾,得到沉淀I為不溶于酸的雜質,溶液I中溶質為FeCl2、CuCl2和HCl,向溶液I中加入X、Y然后調節pH過濾,得到沉淀II,溶液II,除去FeCl2、CuCl2和HCl中的FeCl2,根據氫氧化物沉淀需要的pH知,應該先將FeCl2氧化為鐵鹽,為不引進新的雜質,氧化劑X應該為Cl2或H2O2,然后向溶液中加入CuO調節溶液的pH,所以Y可以是CuO,則沉淀II為Fe(OH)3,然后將溶液II蒸發濃縮、冷卻結晶得到CuCl2.2H2O,最后在HCl氛圍中加熱CuCl2.2H2O得到CuCl2.
(1)通過以上分析知,CuO和酸反應生成銅鹽和水,離子方程式為CuO+2H+=Cu2++H2O,故答案為:CuO+2H+=Cu2++H2O;
(2)步驟②加入氧化劑將亞鐵離子氧化生成鐵離子,然后調節溶液的pH除去鐵離子,選取雙氧水時發生的離子反應為2Fe2++H2O2+2H+=2Fe3++2H2O;故答案為:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)當鐵離子完全沉淀時溶液的pH為3.2,當銅離子出現沉淀時溶液的pH為4.7,調節溶液的pH要除去鐵離子而不能除去銅離子,所以溶液的pH范圍為3.2-4.7,調節溶液pH時不能引入新的雜質,則可以加入CuO或 Cu(OH)2,可選擇bc;故答案為:3.2-4.7;bc;
(4)氯化銅水解,在干燥的HCl氣流中抑制Cu2+的水解,且帶走CuCl2•xH2O受熱產生的水氣,故能得到無水氯化銅,
故答案為:在干燥的HCl氣流中抑制Cu2+的水解,且帶走CuCl2•xH2O受熱產生的水氣,故能得到無水氯化銅;
點評 本題考查混合物的分離和提純,涉及除雜劑的選取、氧化還原反應、儀器的選取等知識點,側重考查整體分析解答能力,會根據儀器的作用選取儀器,難點是確定調節溶液的pH時pH的取值范圍,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 通入CO2氣體產生藍色沉淀 | |
| B. | 該溶液中Na+、NH4+、NO3-、Mg2+可以大量共存 | |
| C. | 與H2S反應的離子方程式:Cu2++S2-=CuS↓ | |
| D. | 與過量濃氨水反應的離子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 序號 | 反應 | 平衡常數 |
| 1 | Au+6HNO3(濃)═Au(NO3)3+3NO2↑+3H2O | <<1 |
| 2 | Au3++4Cl-═AuCl4- | >>1 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  此圖表示可用蒸餾法分離X、Y | B. |  SO2氣體通入溴水中 | ||
| C. |  氨氣通入醋酸溶液中 | D. | 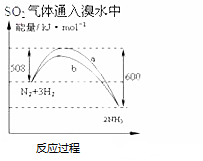 N2(g)+3H2(g)═2NH3(g)△H=-92KJmol |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 某烴A是有機化學工業的基本原料,其產量可以用來衡量一個國家的石油化工發展水平,A還是一種植物生長調節劑,A可發生如圖所示的一系列化學反應,其中①②③屬于同種反應類型.
某烴A是有機化學工業的基本原料,其產量可以用來衡量一個國家的石油化工發展水平,A還是一種植物生長調節劑,A可發生如圖所示的一系列化學反應,其中①②③屬于同種反應類型. ;
; .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氨在生活、生產、科研中有廣泛用途.
氨在生活、生產、科研中有廣泛用途.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,11.2L苯中含有分子數目為0.5NA | |
| B. | 常溫下,1.8g水中含有的電子數為NA | |
| C. | 0.1 mol Cl2與足量氫氧化鈉溶液反應,轉移的電子數為0.2NA | |
| D. | 1L0.1mol/L的NH4CL溶液中含NH4+的數目為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C16H22O5 | B. | C14H16O4 | C. | C14H18O5 | D. | C14H20O5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com