
【題目】(1)在①![]() ②石墨③C60④
②石墨③C60④![]() ⑤CH3CH2OH⑥
⑤CH3CH2OH⑥![]() ⑦
⑦![]() ⑧CH3OCH3中:互為同位素;______互為同分異構體_______;互為同素異形體_______(填序號).
⑧CH3OCH3中:互為同位素;______互為同分異構體_______;互為同素異形體_______(填序號).
(2)現有①CaCl2 ②金剛石 ③NH4Cl ④Na2SO4 ⑤冰等五種物質,按下列要求回答:
I.熔化時不需要破壞化學鍵的是_______,熔點最高的是_________。(填序號)
II.只含有離子鍵的物質是_________,晶體以分子間作用力結合的是_________。(填序號)
(3)寫出下列物質的電子式
①H2O______②NaOH______③NH3______;
(4)寫出CO2的結構式______;寫出硫原子的原子結構示意圖______.
【答案】①⑦ ⑤⑧ ②③ ⑤ ② ① ⑤ ![]()
![]()
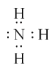 O=C=O
O=C=O 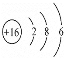
【解析】
(1)①同位素:質子數相同,中子數不同的同一元素的不同原子;同分異構體:分子式相同,結構不同的物質;同素異形體:同種元素形成的不同單質;根據概念分析結果;
(2)先確定晶體類型,在確定化學鍵;
(3)先確定化學鍵類型,在確定電子式;
(4)先確定化學鍵類型,在確定結構式;硫原子為16號元素,寫出原子結構示意圖。
(1)根據同位素:質子數相同,中子數不同的同一元素的不同原子;同分異構體:分子式相同,結構不同的物質;同素異形體:同種元素形成的不同單質。因此①⑦互為同位素;⑤⑧互為同分異構體;②③互為同素異形體;
答案:①⑦ ⑤⑧ ②③
(2)①CaCl2為離子晶體,存在離子鍵;②金剛石為原子晶體,存在共價鍵; ③NH4Cl 離子晶體,存在離子鍵和共價鍵;④Na2SO4為離子晶體,存在離子鍵和共價鍵, ⑤冰為分子晶體,存在共價鍵。
I.熔化時離子晶體破壞離子鍵,原子晶體破壞共價鍵,分子晶體破壞分子間作用力;通常情況下熔點原子晶體>離子晶體>分子晶體;
II.只含有離子鍵的物質是氯化鈣,分子晶體以分子間作用力結合;
答案:⑤ ② ① ⑤
(3)①H2O為共價化合物,存在O-H共價鍵②NaOH中鈉離子和氫氧根離子存在離子鍵,氫氧根離子內部存在O-H共價鍵③氨氣為共價化合物,存在N-H共價鍵;
則電子式為![]() 、
、 ![]() 、
、 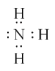 ;
;
答案:![]()
![]()
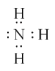
(4)CO2為共價化合物,根據8電子穩定結構,確定結構式為O=C=O;硫原子為16號元素,原子結構示意圖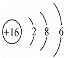 ;
;
答案:O=C=O 


 七星圖書口算速算天天練系列答案
七星圖書口算速算天天練系列答案 初中學業考試導與練系列答案
初中學業考試導與練系列答案科目:高中化學 來源: 題型:
【題目】化學中常借助于圖像這一表現手段以清晰地突出實驗裝置的要點,形象地闡述化學過程的原理。 下列有關化學圖像表現的內容正確的是
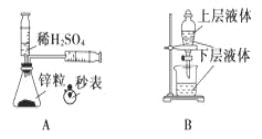
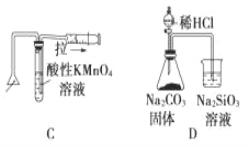
A. 測定一定時間內生成 H2 的反應速率 B. 提取海帶中的碘
C. 檢驗火柴燃燒產生的 SO2 D. 證明非金屬性:Cl>C>Si
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A.工業用焦炭在高溫下還原二氧化硅制得高純硅
B.SiO2可用于制造光導纖維
C.鈉是一種強還原劑,可以把鈦、鋯、鈮等從其熔融鹽中置換出來
D.氧化鎂熔點高達250℃,是優質的耐高溫材料
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關Cl2的說法中,不正確的是
A. Cl2是一種黃綠色的有毒氣體 B. 干燥的Cl2可保存在鋼瓶中
C. 鐵絲在Cl2中燃燒生成FeCl3 D. 氯氣和液氯是兩種不同的物質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】當其他條件不變時,下列說法正確的是
A. 使用催化劑一定能加快反應速率
B. 用粉末狀鋅代替塊狀鋅與稀硫酸反應一定會加快反應速率
C. 在N2+3H2![]() 2NH3反應中,增大N2濃度一定可以使H2全部轉化為NH3
2NH3反應中,增大N2濃度一定可以使H2全部轉化為NH3
D. 當反應物與生成物濃度相等時,可逆反應一定己達到化學反應限度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組中的微粒在指定溶液中一定能大量共存的是( )
A. c(FeCl3)=1.0 mol·L-1的溶液中:HCO![]() 、Cl-、H+、Na+
、Cl-、H+、Na+
B. 常溫下,由水電離出的c(H+)=10-14mol·L-1溶液中:NH![]() 、K+、CO
、K+、CO![]() 、SO
、SO![]()
C. 在c(HCO![]() )=0.1 mol·L-1的溶液中:NH
)=0.1 mol·L-1的溶液中:NH![]() 、AlO
、AlO![]() 、Cl-、NO
、Cl-、NO![]()
D. 常溫下, 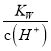 =0.1 mol·L-1的溶液中:K+、NH3·H2O、SO
=0.1 mol·L-1的溶液中:K+、NH3·H2O、SO![]() 、NO
、NO![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】人工腎臟可用間接電化學方法除去代謝產物中的尿素CO(NH2)2,原理如圖。下列有關說法正確的是( )
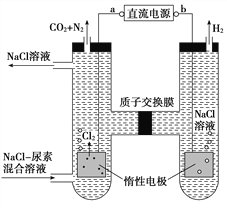
A. a為電源的負極
B. 電解結束后,陰極室溶液的pH與電解前相比將升高
C. 陽極室中發生的電極反應為2H++2e-=H2↑
D. 若兩極共收集到氣體產品13.44 L(標準狀況),則除去的尿素為7.2 g(忽略氣體的溶解)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 298 K時,2H2S(g)+SO2(g)===3S(s)+2H2O(l) 能自發進行,則其ΔH<0
B. 銅的化學性質比鐵穩定,在鐵閘上安裝銅塊可減慢鐵閘的腐蝕速率
C. 鉛蓄電池放電時的負極和充電時的陰極均發生氧化反應
D. 常溫下,pH均為5的鹽酸與氯化銨溶液中,水的電離程度相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來甲醇用途日益廣泛,越來越引起商家的關注。工業上甲醇的合成途徑多種多樣。現在實驗室中模擬甲醇合成反應,在2 L密閉容器內,400 ℃時發生反應CO(g)+2H2(g) ![]() CH3OH(g),體系中n(CO)隨時間的變化如表:
CH3OH(g),體系中n(CO)隨時間的變化如表:
時間(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |

(1)圖中表示CH3OH 的變化的曲線是_______;
(2)下列措施不能提高反應速率的有_________(請用相應字母填空);
a.升高溫度 b.加入催化劑 c.增大壓強 d.及時分離出CH3OH
(3)下列敘述能說明反應達到平衡狀態的是__________(請用相應字母填空);
a.CO和H2的濃度保持不變 b.v(H2)=2 v(CO)
c.CO的物質的量分數保持不變 d.容器內氣體密度保持不變
e.每生成1molCH3OH的同時有2molH-H鍵斷裂
(4)CH3OH與O2的反應可將化學能轉化為電能,其工作原理如圖所示,圖中CH3OH從__________(填A或B)通入,b極的電極反應式是__________。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com