
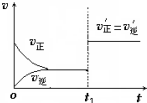
 在其他條件不變的情況下,降低溫度平衡向正反應方向移動,為放熱反應(選填“吸熱”、“放熱”).如圖為反應速率(ν)與時間(t)關系的示意圖,由圖判斷,在t1時刻曲線發生變化的原因是c(填寫編號).
在其他條件不變的情況下,降低溫度平衡向正反應方向移動,為放熱反應(選填“吸熱”、“放熱”).如圖為反應速率(ν)與時間(t)關系的示意圖,由圖判斷,在t1時刻曲線發生變化的原因是c(填寫編號).分析 降低溫度平衡向放熱的方向移動,該反應降低溫度,平衡向正反應方向移動,正反應為放熱反應;t1時刻,正逆反應速率同等程度的增大;催化劑對化學平衡無影響,能改變反應速率.
解答 解:降低溫度平衡向放熱的方向移動,在其他條件不變的情況下,降低溫度平衡向正反應方向移動,所以正反應為放熱反應,t1時刻,正逆反應速率同等程度的增大,則改變的條件為催化劑,催化劑對化學平衡無影響,能改變反應速率,所以C符合,因平衡未移動,則平衡混合物中NH3的百分含量不變,
故答案為:放熱;c;不變.
點評 本題考查化學反應速率及化學平衡,題目難度不大,明確影響反應速率及平衡的外界因素即可解答,注意催化劑對平衡移動無影響.


科目:高中化學 來源: 題型:多選題
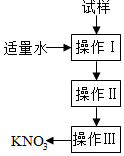 實驗室提純含少量氯化鈉雜質的硝酸鉀的過程如圖所示.下列分析正確的是( )
實驗室提純含少量氯化鈉雜質的硝酸鉀的過程如圖所示.下列分析正確的是( )| A. | 操作Ⅰ是過濾,將固體分離除去 | |
| B. | 操作Ⅱ是加熱濃縮,趁熱過濾,除去雜質氯化鈉 | |
| C. | 操作Ⅲ是過濾、洗滌,將硝酸鉀晶體從溶液中分離出來 | |
| D. | 操作Ⅰ~Ⅲ總共只需一次過濾操作 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/℃ | 1000 | 1100 |
| 平衡常數 | 0.68 | 0.50 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 如圖為實驗室制取乙酸乙酯的裝置.
如圖為實驗室制取乙酸乙酯的裝置.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 肼(N2H4)廣泛用于火箭推進劑、有機合成及電池燃料.請回答下列問題:
肼(N2H4)廣泛用于火箭推進劑、有機合成及電池燃料.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 平衡向逆反應方向移動了 | B. | 物質A的轉化率減少了 | ||
| C. | 物質B的質量分數減小了 | D. | m 小于n |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
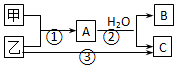
| A. | 若C為酸性氣體,則B可能具有兩性 | |
| B. | 若C是堿性氣體,則B一定是堿 | |
| C. | 若B、C是兩種酸,則B、C一定都是一元酸 | |
| D. | 以上3個轉變可能都是氧化還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 13C與15N有相同的中子數 | B. | 13C的質子數為13 | ||
| C. | 15N與14N互為同位素 | D. | 15N的核外電子數與中子數相同 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com