
某無色透明溶液與金屬鋁反應放出氫氣。下列離子:Mg2+ 、Cu2+、 Ba2+ 、H+、 Ag+ 、SO42- 、HCO3- 、OH-。判斷何者能大量存在于此溶液中:
(1)當生成Al3+時,一定大量存在 ,可能存在 ,一定不存在
(2)當生成AlO2-時,一定大量存在 ,生成氫氣的離子方程式是
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2016屆吉林省高三上學期第五次模擬理綜化學試卷(解析版) 題型:實驗題
肼是重要的化工原料。某探究小組利用下列反應制取水合肼(N2H4·H2O):CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl。

實驗一:制備NaClO溶液
(1)將氯氣通入到盛有NaOH溶液的錐形瓶中,錐形瓶中發生反應的離子方程式為________________。
實驗二:制取水合肼(實驗裝置如圖所示)
控制反應溫度,將分液漏斗中的溶液緩慢滴入三頸燒瓶中,充分反應。加熱蒸餾三頸燒瓶內的溶液,收集108~114 ℃餾分。(已知:N2H4·H2O+2NaClO===N2↑+3H2O+2NaCl)
(2)儀器X的名稱是___________;分液漏斗中的溶液是___________(填“A”或“B”);
A.NaOH和NaClO混合溶液
B.CO(NH2)2溶液
選擇的理由是_____________________________。
實驗三:測定餾分中水合肼的質量分數
水合肼具有還原性,被氧化生成氮氣。測定水合肼的質量分數可采用下列步驟:
a.稱取餾分5.000 g,加入適量NaHCO3固體,經稀釋、轉移、定容等步驟,配制250 mL溶液。
b.移取25.00 mL溶液于錐形瓶中,加入10 mL水,搖勻。
c.用0.2000 mol·L-1碘溶液滴定至溶液出現微黃色且半分鐘內不消失,滴定過程中,溶液的pH保持在6.5左右。記錄消耗碘的標準溶液的體積。
d.進一步操作與數據處理。
(3)水合肼與碘溶液反應的化學方程式為_________________________________;
測定過程中,NaHCO3能控制溶液的pH在6.5左右,原因是______________________。
(4)滴定時,碘的標準溶液盛放在___________(填“酸式”或“堿式”)滴定管中;若三次滴定消耗碘的標準溶液的平均體積為18.00 mL,則餾分中水合肼(N2H4·H2O)的質量分數為________(保留三位有效數字)。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年廣西欽州港經濟開發區中學高一上12月月考化學試卷(解析版) 題型:簡答題
判斷下列分子間能否形成氫鍵。
①HClO4 ②H2SO4 ③H3 PO4 ④HNO3 ⑤H2Se ⑥H3PO2 ⑦C2H5OH ⑧CH3 COOH ⑨H2 O2 ⑩HBrO3 ⑪NaOH
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高二上學期期中考試化學試卷(解析版) 題型:填空題
硫一碘循環分解水制氫主要涉及下列反應:
Ⅰ、SO2+2H2O+I2===H2SO4+2HI; Ⅱ、2HI H2+I2; Ⅲ、2H2SO4===2SO2↑+O2↑+2H2O
H2+I2; Ⅲ、2H2SO4===2SO2↑+O2↑+2H2O
(1)分析上述反應,下列判斷正確的是 。
a.反應Ⅲ易在常溫下進行
b.反應Ⅰ中SO2氧化性比HI強
c.循環過程中需補充H2O
d.循環過程中產生1mol O2的同時產生1mol H2
(2)一定溫度下,向1L密閉容器中加入1mol HI(g),發生反應Ⅱ,H2物質的量隨時間的變化如圖所示。
0~2 min內的平均反應速率v(HI)= 。

(3)實驗室用Zn和稀硫酸制取H2,加入少量下列試劑中()產生H2的速率將增大(填字母)。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2為燃料可制成氫氧燃料電池。
已知2H2(g)+O2(g)=== 2H2O(l) △H=-572KJ·mol-1
某氫氧燃料電池釋放228.8KJ電能時,生成1mol液態水,該電池的能量轉化為 。
(5)利用氫氣合成二甲醚的三步反應如下:
①2H2(g) + CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③CO(g) + H2O(g)  CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
總反應:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH=_____ _;
CH3OCH3(g) + CO2 (g)的ΔH=_____ _;
(6)判斷該可逆反應達到化學平衡狀態的標志是 (填字母)。
a.v生成(CH3OH)= v消耗(CO)
b.混合氣體的密度不再改變
c.混合氣體的平均相對分子質量不再改變
d.CO、H2、CH3OH的濃度均不再變化
(7)在某溫度下,向一個容積不變的密閉容器中通入2.5mol CO和7.5mol H2反應生成CH3OH(g),達到平衡時CO的轉化率為90%,此時容器內的壓強為開始時的 倍。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高二上學期12月月考化學試卷(教師版) 題型:選擇題
下列溶液一定呈中性的是
A.pH=7的溶液
B.c(H+)=c(OH-)=10-6mol/L溶液
C.使石蕊試液呈紫色的溶液
D.酸與堿恰好完全反應生成正鹽的溶液
查看答案和解析>>
科目:高中化學 來源:2014-2015學年江西省高三上學期第六次考試理綜化學試卷(解析版) 題型:實驗題
肼是重要的化工原料。某探究小組利用下列反應制取水合肼(N2H4·H2O)。
CO(NH2) 2+ 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
實驗一: 制備NaClO溶液
(1)將氯氣通入到盛有NaOH的錐形瓶中,錐形瓶中發生反應的離子方程式是_______________;
實驗二: 制取水合肼(實驗裝置如圖所示)
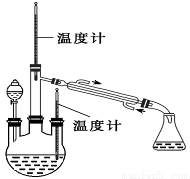
控制反應溫度,將分液漏斗中溶液緩慢滴入三頸燒瓶中,充 分反應。加熱蒸餾三頸燒瓶內的溶液,收集108~114℃餾分。
(已知:N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl)
(2)分液漏斗中的溶液是 (填標號A或B);
A.NaOH和NaClO混合溶液
B.CO (NH2) 2溶液
選擇的理由是 ;
實驗三: 測定餾分中肼含量
水合肼具有還原性,可以生成氮氣。測定水合肼的質量分數可采用下列步驟:
a.稱取餾分5.000g,加入適量NaHCO3固體,經稀釋、轉移、定容等步驟,配制250mL溶液。
b.移取25.00 mL于錐形瓶中,加入10mL水,搖勻.
c.用0.2000mol/L碘溶液滴定至溶液出現微黃色且半分鐘內不消失,滴定過程中,溶液的pH保持在6.5左右。記錄消耗碘的標準液的體積。
d.進一步操作與數據處理
(3)水合肼與碘溶液反應的化學方程式 ;滴定過程中,NaHCO3能控制溶液的pH在6.5左右,原因是
(4)滴定時,碘的標準溶液盛放在 滴定管中(選填:“酸式”或“堿式”) ;若本次滴定消耗碘的標準溶液為18.00mL,餾分中水合肼(N2H4·H2O)的質量分數
為 (保留三位有效數字);
(5)為獲得更可靠的滴定結果,步驟d中進一步操作主要是: 。
查看答案和解析>>
科目:高中化學 來源:2016屆福建省閩粵聯合體高三上學期第三次聯考化學試卷(解析版) 題型:選擇題
向含有c(FeCl3)=0.2 mol·L-l、c(FeCl2)=0.1 mol·L-l的混合溶液中滴加稀NaOH溶液,可得到一種黑色分散系,其中分散質粒子是直徑約為9.3 nm的金屬氧化物,下列有關說法中正確的是
A.該分散系的分散質為Fe2O3
B.在電場作用下,陰極附近分散系黑色變深,則說明該分散系帶正電荷
C.加入NaOH時發生的反應可能為:Fe2++2Fe3++8OH-=== Fe3O4+4H2O
D.可用過濾的方法將黑色金屬氧化物與Na+分離開
查看答案和解析>>
科目:高中化學 來源:2016屆福建省高三上12月月考化學試卷(解析版) 題型:選擇題
對下列各溶液進行電解,通電一段時間后,溶液顏色不會發生顯著改變的是:
A.以銅為電極,電解1 mol·L-1 H2SO4溶液
B.以石墨為電極,電解1 mol·L-1 KBr溶液
C.以石墨為電極,電解含酚酞的飽和食鹽水
D.以銅為電極,電解CuSO4溶液
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖南省高二上第三次月考化學試卷(解析版) 題型:選擇題
濃度均為0.10mol/L、體積均為V0的MOH和ROH溶液,分別加水稀釋至體積V,pH隨 的變化如圖所示,下列敘述錯誤的是
的變化如圖所示,下列敘述錯誤的是
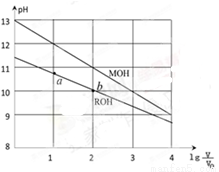
A.MOH的堿性強于ROH的堿性
B.ROH的電離程度:b點大于a點
C.若兩溶液無限稀釋,則它們的c(OH-)相等
D.當 =2時,若兩溶液同時升高溫度則
=2時,若兩溶液同時升高溫度則  增大
增大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com