
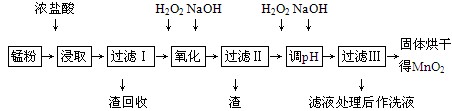
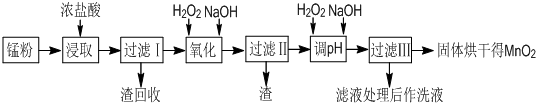
回收的廢舊鋅錳干電池經過處理后得到錳粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由錳粉制取MnO2的步驟如下圖所示。
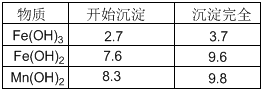
生成氫氧化物沉淀的pH
|
物質 |
開始沉淀 |
沉淀完全 |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Mn(OH)2 |
8.3 |
9.8 |
根據上圖所示步驟并參考表格數據,回答下列問題。
(1)在加熱條件下用濃鹽酸浸取錳粉,所得溶液中含有Mn2+、Fe2+等。MnO2與濃鹽酸反應的離子方程式為___________________________________________
(2)錳粉經濃鹽酸浸取,過濾Ⅰ除去不溶雜質后,向濾液中加入足量H2O2溶液,其作用是____________________________________________________________。
(3)過濾Ⅰ所得濾液經氧化后,需加入NaOH溶液調節pH約為5.1,其目的是___________________________________________________________。
(4)過濾Ⅱ所得濾液加入足量H2O2溶液并加入NaOH溶液調節pH約為9,使Mn2+氧化得到MnO2,反應的離子方程式為_____________________________________________。
(5)實驗室進行過濾操作時,需要用到的玻璃儀器有________________________
(1)MnO2+4H++2Cl-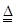 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)將Fe2+氧化成Fe3+
(3)將Fe2+完全轉化為Fe(OH)3沉淀,并防止Mn2+轉化成Mn(OH)2沉淀
(4)Mn2++H2O2+2OH-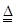 MnO2↓+2H2O
MnO2↓+2H2O
(5)漏斗、燒杯、玻璃棒
【解析】MnO2具有較強的氧化性,可將濃鹽酸中的Cl-氧化為Cl2,反應的離子方程式為MnO2+4H++2Cl-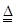 Mn2++Cl2↑+2H2O。H2O2具有較強的氧化性,可將Fe2+氧化成Fe3+。過濾Ⅰ所得濾液經氧化后,需加入NaOH溶液調節pH約為5.1,其目的是將Fe2+完全轉化為Fe(OH)3沉淀,并防止Mn2+轉化成Mn(OH)2沉淀。H2O2溶液與Mn2+反應的離子方程式為Mn2++H2O2+2OH-===MnO2↓+2H2O。過濾操作時需要用到的玻璃儀器有漏斗、燒杯、玻璃棒
Mn2++Cl2↑+2H2O。H2O2具有較強的氧化性,可將Fe2+氧化成Fe3+。過濾Ⅰ所得濾液經氧化后,需加入NaOH溶液調節pH約為5.1,其目的是將Fe2+完全轉化為Fe(OH)3沉淀,并防止Mn2+轉化成Mn(OH)2沉淀。H2O2溶液與Mn2+反應的離子方程式為Mn2++H2O2+2OH-===MnO2↓+2H2O。過濾操作時需要用到的玻璃儀器有漏斗、燒杯、玻璃棒


科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
(16分)回收的廢舊鋅錳干電池經過處理后可得到錳粉(主要含MnO2、Mn(OH)2、Fe、NH4Cl和炭黑等),由錳粉制取MnO2的步驟和數據如下:
| 物質 | 開始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)2 | 8.3 | 9.8 |
(1)在加熱條件下,用濃鹽酸浸取錳粉得到含有Mn2+、Fe3+等離子的溶液,MnO2與濃鹽酸反應的離子方程式 ,該處理方法的缺點 。
(2)步驟I中濾渣的化學式 ,步驟I中濾渣的化學式 。
(3)向步驟I的濾液中加足量H2O2的作用為 。再加NaOH溶液調節pH在3.7<pH<8.3,目的是 。
(4)向步驟II的濾液中H2O2溶液,再加NaOH溶液調節pH為9,使Mn2+轉化成MnO2,在這一過程中H2O2起 (填氧化劑、還原劑)的作用。
查看答案和解析>>
科目:高中化學 來源:廣東省惠州市2011屆高三第一次調研考試(理綜)化學部分 題型:填空題
(16分)回收的廢舊鋅錳干電池經過處理后可得到錳粉(主要含MnO2、Mn(OH)2、Fe、NH4Cl和炭黑等),由錳粉制取MnO2的步驟和數據如下:
| 物質 | 開始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)2 | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化學 來源:2013-2014學年廣東省汕頭市高三3月高考模擬理綜化學試卷(解析版) 題型:填空題
回收的廢舊鋅錳干電池經過處理后得到錳粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由錳粉制取MnO2的步驟如下圖所示。
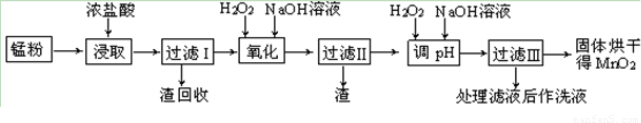
根據上圖所示步驟并參考表格數據,回答下列問題。
物 質 | 開始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
(1)在加熱條件下用濃鹽酸浸取錳粉,所得溶液中含有Mn2+、Fe2+等。MnO2與濃鹽酸反應的離子方程方程式:?????????????????????????????????????????????????????? _。
(2)酸浸時,浸出時間對錳浸出率的影響如下圖所示,工業采用的是浸取60 min,其可能原因是???????????????????????????????????????????????????? 。
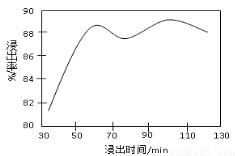
(3)錳粉經濃鹽酸浸取,過濾I除去不溶雜質后,向濾液中加入足量H2O2溶液,其作用是????????????????????????????????? 。
(4)過濾I所得濾液經氧化后,需加入NaOH溶液調節pH約為5.1,其目的是?????????????????????????????????????????????? 。
(5)過濾Ⅱ所得濾液加入足量H2O2溶液并加入NaOH溶液調節pH約為9,使Mn2+ 氧化得到MnO2,反應的離于方程式為????????????????????????????????????????????????????? 。
(6)工業上利用KOH和MnO2為原料制取KMnO4。主要生產過程分兩步進行:第一步將MnO2和固體KOH粉碎,混合均勻,在空氣中加熱至熔化,并連續攪拌以制取K2MnO4;第二步為電解K2MnO4的濃溶液制取KMnO4。
① 第一步反應的化學方程式為???????????????????????????????????????????????????????????? 。
② 電解K2MnO4的濃溶液時,電解池中陰極的實驗現象為???????????????????????????????????????? 。
查看答案和解析>>
科目:高中化學 來源:廣東省惠州市2010-2011學年高三第一次調研考試(理綜)化學部分 題型:填空題
(16分)回收的廢舊鋅錳干電池經過處理后可得到錳粉(主要含MnO2、Mn(OH)2、Fe、NH4Cl和炭黑等),由錳粉制取MnO2的步驟和數據如下:

|
物質 |
開始沉淀 |
沉淀完全 |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Fe(OH)2 |
8.3 |
9.8 |
(1)在加熱條件下,用濃鹽酸浸取錳粉得到含有Mn2+、Fe3+等離子的溶液,MnO2與濃鹽酸反應的離子方程式 ,該處理方法的缺點 。
(2)步驟I中濾渣的化學式 ,步驟I中濾渣的化學式 。
(3)向步驟I的濾液中加足量H2O2的作用為 。再加NaOH溶液調節pH在3.7<pH<8.3,目的是 。
(4)向步驟II的濾液中H2O2溶液,再加NaOH溶液調節pH為9,使Mn2+轉化成MnO2,在這一過程中H2O2起 (填氧化劑、還原劑)的作用。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com