
【題目】在給定條件下,下列選項所示的物質間轉化均能實現的是( )
A. NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B. AlCl3(aq)![]() Al(OH)3(s)
Al(OH)3(s)![]() Al2O3(s)
Al2O3(s)
C. S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
D. N2(g)![]() NH3(g)
NH3(g)![]() NaHCO3(s)
NaHCO3(s)
科目:高中化學 來源: 題型:
【題目】某研究小組同學對市售某種補鐵口服液的成分進行探究。根據名稱認為該糖漿中含有Fe2+,設計方案進行驗證。

I.設計方案如下:
| 方案 | 試劑X | 預期現象 |
方案i | 1mL 1 mol/L NaOH溶液 | a | |
方案ii | 1mL 1 mol/L 酸性KMnO4溶液 | b | |
方案iii | 依次加入5滴KSCN溶液、1mL氯水 | c |
(1)方案i的預期現象是產生白色沉淀,逐漸變為灰綠色,最終變為紅褐色。產生白色沉淀的離子方程式是_________,最終變為紅褐色的化學方程式是________。
(2)方案ii的預期現象是_________。
(3)方案iii的預期現象是________,反應中氯水參與反應的的離子方程式是____。
II.進行實驗操作,得到的實際現象如下:
方案 | 實際現象 | 是否與預期現象相同 |
方案i | 產生灰綠色渾濁,長時間不變紅褐色 | 不同 |
方案ii | 相同 | |
方案iii | 自始至終無明顯現象 | 不同 |
(4)為探究實驗中出現異常現象的原因,該小組同學查看說明書,得知有關補鐵口服液成分的如下:
本品每毫升含主要成分葡萄糖酸亞鐵30毫克,
輔料為:蔗糖、香精、枸檬酸、羥苯乙酯。
結合資料對異常現象產生的原因進行猜想:______________;為驗證其猜想,在方案iii的基礎上繼續加入過量的氯水,得到了預期的現象。
(5) 實驗反思:方案ii中預期現象與實驗現象相同,并不能證明補鐵口服液中一定含有Fe2+,理由是______。
(6)小組同學進一步提出研究問題:仍選用之前用過的試劑,設計實驗驗證某久置的補鐵口服液(計為Y
實驗序號 | 操作 | 現象 |
ⅳ | 取2 mL溶液Y,加入1滴KSCN,再加入1 mL水 | 溶液顯紅色 |
V |
實驗V的操作及現象是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能源在人類生活中應用廣泛。回答下列問題:
(1)氫氣燃燒時放出大量的熱,這是由于反應物的總能量____生成物的總能量(選填“大于”“小于”或“等于”,下同),從化學反應的本質角度來看,是由于斷裂反應物中的化學鍵吸收的總能量_____形成產物的化學鍵釋放的總能量。
(2)H2被認為是21世紀礦物燃料的理想能源,每克氫氣和汽油燃燒放出的熱量分別為55kJ和46kJ。汽油可由石油經___和____獲得;請分析氫氣作為能源替代汽油的優勢:_____;____(寫兩點)。
(3)在氫氧堿性燃料電池中,負極發生反應的電極反應式:___,正極的電極反應式為____。若反應后得到5.4g液態水,此時氫氧燃料電池轉移的電子數為____。
(4)如圖所示的裝置,在盛有水的燒杯中,鐵圈和銀圈的連接處吊著一根絕緣的細絲,使之平衡。小心地往燒杯中央滴入CuSO4溶液。

片刻后可觀察到的現象是(指懸吊的金屬圈)____。
A.鐵圈和銀圈左右搖擺不定 B.保持平衡狀態不變
C.鐵圈向下傾斜 D.銀圈向下傾斜
(5)鐵及鐵的化合物應用廣泛,如FeCl3可用作催化劑、印刷電路銅板腐蝕劑和外傷止血劑等。
①寫出FeCl3溶液腐蝕印刷電路銅板的離子方程式_____。
②若將①中的反應設計成原電池,寫出負極的電極反應式____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以高硫鋁土礦(主要成分為Al2O3、Fe2O3、SiO2,少量FeS2和金屬硫酸鹽)為原料,生產氧化鋁并獲得Fe3O4的部分工藝流程如圖:
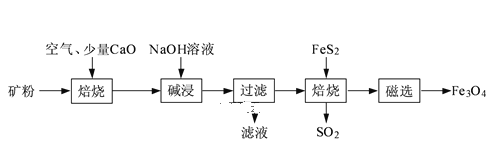
(1)焙燒過程均會產生SO2,用NaOH溶液吸收過量SO2的離子方程式為____。
(2)添加1%CaO和不添加CaO的礦粉焙燒,其硫去除率隨溫度變化曲線如題圖所示。
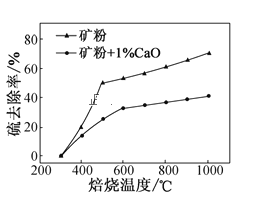
已知:多數金屬硫酸鹽的分解溫度都高于600℃
硫去除率=(1![]() )×100%
)×100%
①不添加CaO的礦粉在低于500℃焙燒時,去除的硫元素主要來源于____。
②700℃焙燒時,添加1%CaO的礦粉硫去除率比不添加CaO的礦粉硫去除率低,其主要原因是___。
(3)向“過濾”得到的濾液中通入過量CO2,鋁元素存在的形式由___(填化學式)轉化為____(填化學式)。
(4)“過濾”得到的濾渣中含大量的Fe2O3。Fe2O3與Al混合在高溫下發生的反應方程式____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在托盤天平的兩盤上,分別放有兩個質量相同的燒杯,各盛有6 mol·L-1HCl 100 mL,使天平達到平衡。分別向兩燒杯中加入不超過5 g 的鎂和鋁,若要使其充分反應后天平仍保持平衡,則加入的鎂與鋁的質量之比為( )
A. 1∶1 B. 24∶27 C. 12∶9 D. 32∶33
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在25℃時,向20.00mL0.10mol/L一元弱堿MOH溶液中滴0.10mol/LHCl溶液,混合溶液的pH、pOH變化曲線如圖所示。已知pOH=-lgc(OH-)。下列說法錯誤的是( )
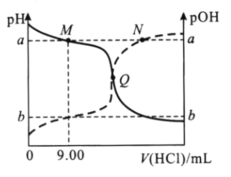
A.a+b=14
B.Q點消耗鹽酸的體積小于20.00mL
C.M點和N點溶液中,![]() 相等
相等
D.當V(HCl)=10.00mL時,c(M+)-c(MOH)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同學設計如圖所示的實驗裝置,通過測量反應產生的CO2和H2O的質量,來確定該混合物中各組分的質量分數。

(1)實驗步驟:
①按圖(夾持儀器未畫出)組裝好實驗裝置后,首先進行的操作是__________。
②稱取樣品,并將其放入硬質玻璃管中,稱量裝濃硫酸的洗氣瓶C的質量和裝堿石灰的U形管D的質量。
③打開活塞K1、K2,關閉K3,緩緩鼓入空氣數分鐘,其目的是________。
④關閉活塞K1、K2,打開K3,點燃酒精燈加熱至不再產生氣體。裝置B中發生反應的化學方程式為________、________。
⑤打開活塞K1,緩緩鼓入空氣數分鐘,然后拆下裝置,再次稱量洗氣瓶C的質量和U形管D的質量。
(2)關于該實驗方案,請回答下列問題。
①若加熱反應后不鼓入空氣,對測定結果的影響是_______________。
②E處干燥管中盛放的藥品是堿石灰,其作用是_____________,如果實驗中沒有該裝置,則會導致測量結果NaHCO3的質量_____________(填“偏大”“偏小”或“無影響”)。
③若樣品質量為w g,反應后C、D裝置增加的質量分別為m1g、m2g,則混合物中Na2CO3·10H2O的質量分數為________(用含w、m1、m2的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】制取氯化鐵粉末,已知氯化鐵粉末很容易吸水生成結晶化合物FeCl3+6H2O=FeCl3·6H2O。
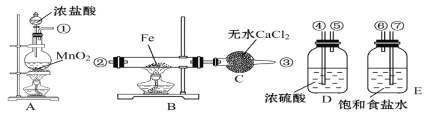
(1)按照氣體流向從左到右順序連接儀器應是(填儀器接口順序):①接___,___接___,___接___。
(2)燒瓶A中氧化劑是______(填物質名稱),發生反應的離子方程式_______________________, B中反應的化學方程式_________________________________。
(3)容器D的作用是_______________________,容器E的作用是_________________
(4)A、B中的酒精燈應先點燃_____處(填“A”或“B”)的酒精燈,理由是____________________
(5)這套實驗裝置是否完整?_____(填“是”或“否”),若不完整,還須補充___________裝置(若第一問填“是”,則此問不需要作答)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】于固定體積的密閉容器中進行的氣體反應A(g)+B(g) ![]() C(s)+2D(g),可以說明在恒溫下已達到平衡狀態的是
C(s)+2D(g),可以說明在恒溫下已達到平衡狀態的是
①反應容器中壓強不隨時間變化而變化 ②A氣體和B氣體的生成速率相等 ③混合氣體的平均摩爾質量不隨時間變化而變化 ④反應混合氣體的密度不隨時間變化而變化
A. ③④B. ②③C. ①③D. ①④
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com