
| A.分液時,分液漏斗下層液體從下端放出,上層液體從上口倒出 |
| B.蒸餾時,應使溫度計水銀球靠近蒸餾燒瓶支管口 |
| C.蒸發結晶時應將溶液直接蒸干 |
| D.稱量非腐蝕性藥品應放在托盤天平左盤的稱量紙上,砝碼放在托盤天平右盤的稱量紙上 |
| 實驗步驟 | 現象 | 結論 |
| ①分別取等體積2mol/L的硫酸于試管中 ② | Mg產生氣泡速率快于Fe,Cu無明顯變化 | 金屬性質越活潑,反應速率越快 |
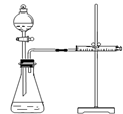


 新題型全程檢測期末沖刺100分系列答案
新題型全程檢測期末沖刺100分系列答案科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題

| 物質 | 開始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 試劑 | 價格(元/噸) |
| 漂液(含NaClO,25.2%) | 450 |
| 雙氧水(含H2O2,30%) | 2400 |
| 燒堿(含98%NaOH) | 2100 |
| 純堿(含99.5%Na2CO3) | 600 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題

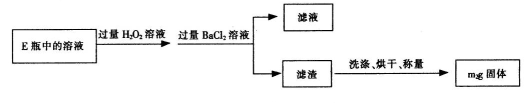
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
| 實驗操作 | 預期現象和結論 |
| 步驟1:取適量產物樣品于潔凈燒杯中,加入足量蒸餾水,充分攪拌,靜置,取上層清液備用。 | 有不溶的黑色固體。 |
| 步驟2:取適量步驟1清液于試管中, | |
| 步驟3: | |
| 滴定 次數 | 待測溶液 的體積/mL | 消耗標準鹽酸的體積 | |
| V1/mL | V2/mL | ||
| 1 | 25.00 | 15.02 | 4.97 |
| 2 | 25.00 | 14.98 | 5.03 |
| 3 | 25.00 | 13.21 | 6.75 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.觀察法 | B.分類法 | C.實驗法 | D.比較法 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
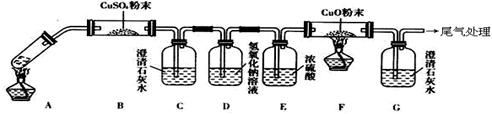
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com