
下列實驗中,操作和現象以及對應結論都正確且現象與結論具有因果關系的是( )
序號 | 操作和現象 | 結論 |
A | 取少量BaSO4固體于試管中,加入足量的鹽酸,沉淀不溶解。 | BaSO4不溶于鹽酸,且可以用鹽酸 和BaCl2溶液檢驗SO42- |
B | 往乙醇中加入適量濃硫酸制備乙烯, | 證明乙烯能被酸性高錳酸鉀氧化 |
C | 常溫下,測得飽和NaA溶液的pH大于飽和NaB溶液 | 常溫下水解程度:A﹣>B﹣ |
D | 在分液漏斗中加入碘水后再加入CCl4,充分振蕩,分層,且上層溶液呈紫色 | CCl4可作為碘的萃取劑 |
A. A B. B C. C D. D
科目:高中化學 來源:2016-2017學年廣西省桂林市高一下學期開學考化學試卷(解析版) 題型:選擇題
下列事實不能說明非金屬性Cl﹥I的是( )
A. KClO3+I2=KIO3+Cl2 B. Cl2+2I-=2Cl-+I2
C. 酸性:HClO4﹥HIO4 D. 氧化性:Cl2﹥I2
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省高一下學期開學考試化學試卷(解析版) 題型:選擇題
在杠桿的兩端分別掛著質量相同的鋁球和鐵球,此時杠桿平衡。然后將兩球分別浸沒在溶液質量相等的稀燒堿溶液和硫酸銅溶液中一段時間,如圖所示。下列說法正確的是( )
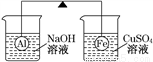
A. 鋁球表面有氣泡產生,且有白色沉淀生成,杠桿不平衡
B. 鋁球表面有氣泡產生,溶液澄清;鐵球表面有紅色物質析出,溶液藍色變淺,杠桿右邊下沉
C. 反應后去掉兩燒杯,杠桿仍平衡
D. 右邊球上出現紅色,左邊溶液的c(OH-)增大
查看答案和解析>>
科目:高中化學 來源:2017屆廣西省桂林市、崇左市高三聯合調研考試理科綜合化學試卷(解析版) 題型:選擇題
化學與生產生話息息相關下列有關說法錯誤的是
A. 硅膠可用作食品的抗氧化劑 B. 可用熱堿水清洗炊具上的油漬
C. 鐵表面鍍鋅可增強其抗腐蝕性 D. 大量燃燒化石燃料是導致霧霾天氣的重要因素之一
查看答案和解析>>
科目:高中化學 來源:2017屆江西省九江市十校高三第二次聯考理科綜合化學試卷(解析版) 題型:簡答題
用HNO3和HF的混酸處理某金屬后,產生的酸洗廢液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-等。下圖是綜合利用該酸洗廢液的工藝流程:
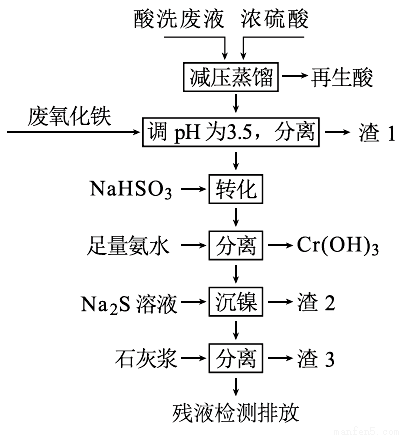
已知:
金屬離子開始沉淀和沉淀完全時的pH:
Fe3+ | Ni2+ | Cr3+ | |
開始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
②Ni2+與足量氨水的反應為:Ni2++6NH3  [Ni(NH3)6]2+
[Ni(NH3)6]2+
(1)再生酸中含有HNO3,采取減壓蒸餾的目的為____________,
(2)濾渣1的主要成份為:____________。
(3)請寫出“轉化”時NaHSO3與Cr2O72-發生反應的氧化劑與還原劑的物質的量之比:________。
(4)已知[Ni(NH3)6]2+為難電離的絡合離子,則“沉鎳”的離子方程式為:____________。
(5)濾渣3的主要成分為CaSO4、Ca(OH)2和_____。
(6)經檢測,最后的殘液中c(Ca2+)=0.001 mol•L-1,則殘液中F-濃度為____mg•L-1,______(填“符合”或“不符合”)排放標準[已知Ksp(CaF2)=4×10-11,國家排放標準要求氟離子濃度小于10 mg•L-1]。
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省衡陽市高三實驗班第六次月考理綜化學試卷(解析版) 題型:填空題
工業生產中產生的SO2、NO直接排放將對大氣造成嚴重污染.利用電化學原理吸收SO2和NO,同時獲得 Na2S2O4和 NH4NO3產品的工藝流程圖如下(Ce為鈰元素).
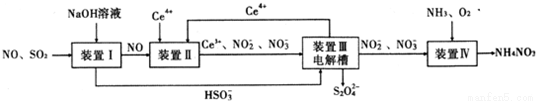
請回答下列問題.
(1)裝置Ⅱ中NO在酸性條件下生成NO2-的離子方程式__________________;
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2與NaOH溶液反應后的溶液中,它們的物質的量分數ω與溶液pH的關系如圖1所示
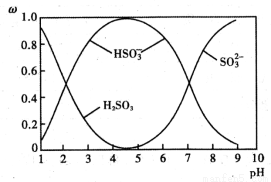
①下列說法正確的是 (填標號)。
A.pH=7時,溶液中c( Na+)<c (HSO3-)+c(SO32-)
B.由圖中數據,可以估算出H2SO3的第二級電離平衡常數Ka2≈10-7
C.為獲得盡可能純的 NaHSO3,應將溶液的pH控制在 4~5為宜
D.pH=9時溶液中c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)
②若1L1mol/L的NaOH溶液完全吸收13.44L(標況下)SO2,則反應的總離子方程式為 。
③取裝置Ⅰ中的吸收液vmL,用cmol/L的酸性高錳酸鉀溶液滴定。酸性高錳酸鉀溶液應裝在 (填“酸式”或“堿式”)滴定管中,判斷滴定終點的方法是 。
(3)裝置Ⅲ 的作用之一是再生Ce4+ ,其原理如下圖所示。
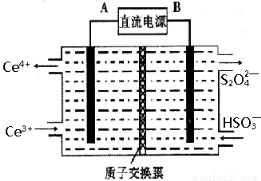
圖中A為電源的 (填“正”或“負”)極。右側反應室中發生的主要電極反應式為 。
(4) 已知進入裝置Ⅳ的溶液中NO-2的濃度為 0.4 mol/L ,要使 1m3該溶液中的NO-2完全轉化為 NH4NO3,需至少向裝置Ⅳ中通入標準狀況下的 O2的體積為 L。
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省衡陽市高三實驗班第六次月考理綜化學試卷(解析版) 題型:選擇題
已知常溫下在溶液中可發生如下兩個離子反應Ce4++Fe2+=Fe3++ Ce3+ ,Sn2+ + 2Fe3+ = 2Fe2+ + Sn4+。由此可以確定Fe2+、Ce3+、Sn2+ 三種離子的還原性最強和最弱的離子分別是
A.Sn2+ 和Ce3+ B.Sn2+ 和Fe2+
C.Ce3+和Sn2+ D.Fe2+和Ce3+
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省大同市高一3月月考化學試卷(解析版) 題型:選擇題
四種主族元素的離子aXm+、bYn+、cZn-和dRm-(a、b、c、d為元素的原子序數),它們具有相同的電子層結構,若m>n,則下列敘述正確的是( )。
①a-b=n-m ②元素的原子序數:a>b>c>d ③元素非金屬性:Z>R ④最高價氧化物對應的水化物的堿性:X>Y
A. 只有③ B. ①②③④ C. ①②③ D. ②③
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省太原市高一3月階段性測試化學試卷(解析版) 題型:選擇題
下列有關硫酸和硝酸的說法中正確的是
A. 將過量的Zn投入一定量的濃H2SO4中,最終生成的氣體只有SO2
B. 向裝有Fe(NO3)2溶液的試管中加入稀H2SO4,在管口觀察到紅棕色氣體
C. 向50 mL 12 mol·L-1的濃硝酸中加入足量銅片其充分反應,生成0.3mol NO2
D. 濃硫酸是一種干燥劑,能夠干燥氫氣、氧氣、氨氣等氣體,但不能干燥有較強還原性的HI、H2S等氣體
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com