
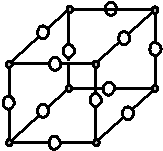
 現有X、Y、Z、W原子序數依次增大的四種元素,常溫下X元素單質的密度在自然界中最小,Y是短周期元素中未成對電子數與原子序數之比最大的原子,Z元素基態原子的核外電子排布式中,s亞層電子總數與p亞層電子總數相等,且Y與Z可形成多種氣態化合物,W是常見的有色可變價金屬單質,常溫下可溶于Y的最高價氧化物水化物中,其基態原子的內層軌道全部排滿電子,且最外層電子數為1.
現有X、Y、Z、W原子序數依次增大的四種元素,常溫下X元素單質的密度在自然界中最小,Y是短周期元素中未成對電子數與原子序數之比最大的原子,Z元素基態原子的核外電子排布式中,s亞層電子總數與p亞層電子總數相等,且Y與Z可形成多種氣態化合物,W是常見的有色可變價金屬單質,常溫下可溶于Y的最高價氧化物水化物中,其基態原子的內層軌道全部排滿電子,且最外層電子數為1.分析 常溫下X元素單質的密度在自然界中最小,是H,Y是短周期元素中未成對電子數與原子序數之比最大的原子,是N元素;Z元素基態原子的核外電子排布式中,s亞層電子總數與p亞層電子總數相等是1s22s22p4或1s22s22p63s2,但Y與Z可形成多種氣態化合物,因此是O元素;W的基態原子的內層軌道全部排滿電子,且最外層電子數為1,是Cu,據此進行答題.
解答 解:常溫下X元素單質的密度在自然界中最小,是H,Y是短周期元素中未成對電子數與原子序數之比最大的原子,是N,Z元素基態原子的核外電子排布式中,s亞層電子總數與p亞層電子總數相等是1s22s22p4或1s22s22p63s2,但Y與Z可形成多種氣態化合物,因此是O,W的基態原子的內層軌道全部排滿電子,且最外層電子數為1,是Cu,
(1)根據晶胞結構,利用均攤法可知N:8×$\frac{1}{8}$=1,Cu:12×$\frac{1}{4}$=3,
故答案為:3;
(2)N原子的2p能級處于半充滿狀態,而原子處于半充滿、全充滿、全空是穩定結構,因此第一電離能N>O,
故答案為:N;
(3)①與N2O互為等電子體的分子的化學式為CO2,
故答案為:CO2;
②互為等電子體的物質的結構相似,因此②N2O的空間構型為直線形
故答案為:直線形;
(4)Cu(NH3)4Cl2分子中的1個NH3含4個σ鍵,4個NH3含12個σ鍵,4個NH3與Cu2+形成4個配位鍵,因此共含16個σ鍵,所以1mol該配合物中含有σ鍵的數目為16NA或16×6.02×1023個,
故答案為:16NA或16×6.02×1023.
點評 本題考查結構性質位置關系應用,題目難度中等,試題涉及晶胞結構、氫鍵、分子結構與性質、雜化軌道、等電子體、化學鍵等知識,正確推斷各元素為解答關鍵,注意掌握原子結構與元素周期表、元素周期律的關系.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,則含40.0 g NaOH的稀溶液與稀醋酸完全中和,放出小于57.3 kJ的熱量 | |
| B. | 已知2 H2(g)+O2(g)=2 H2O(g)△H=-483.6 kJ•mol-1,則氫氣的燃燒熱為241.8kJ•mol-1 | |
| C. | 已知2 C(s)+2 O2(g)=2 CO2(g)△H=a 2 C(s)+O2(g)=2 CO(g)△H=b,則a>b | |
| D. | 已知P(白磷,s)=P(紅磷,s)△H<0,則白磷比紅磷穩定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  NaOH溶液 | B. |  稀硫酸 | C. |  稀硝酸 | D. |  稀鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3CHO | B. | CH3- -CH3 -CH3 | C. | HCOOH | D. | CH3OCOOCH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 ,該化合物屬于離子(填“共價”或“離子”)化合物.
,該化合物屬于離子(填“共價”或“離子”)化合物. ,該化合物是由極性(填“極性”“非極性”下同)鍵形成的.
,該化合物是由極性(填“極性”“非極性”下同)鍵形成的.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定條件下,1molN2和3mol H2充分反應,生成物中的 N-H鍵的數目為6NA | |
| B. | 23g NO2和 N2O4的混合物中原子總數為1.5NA | |
| C. | 1L 0.1mol•L-1的Na2S溶液中S2- 與 HS- 的總數為0.1NA | |
| D. | 向FeI2溶液中通入適量的氯氣,當有1molFe2+被氧化時,總共轉移電子的數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 等質量的鐵與過量的鹽酸在不同的實驗條件下進行反應,測定在不同時間(t)產生氣體體積(V)的數據,根據數據繪制得到圖1,則曲線a、b、c、d所對應的實驗組別可能是( )
等質量的鐵與過量的鹽酸在不同的實驗條件下進行反應,測定在不同時間(t)產生氣體體積(V)的數據,根據數據繪制得到圖1,則曲線a、b、c、d所對應的實驗組別可能是( )| 組別 | C(HCL)(mol/L) | 溫度(℃) | 狀態 |
| 1 | 2.0 | 25 | 塊狀 |
| 2 | 2.5 | 30 | 塊狀 |
| 3 | 2.5 | 50 | 塊狀 |
| 4 | 2.5 | 30 | 粉末狀 |
| A. | 3-4-1-2 | B. | 1-2-4-3 | C. | 4-2-3-1 | D. | 4-3-2-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃硫酸和乙醇的混合液(3:1)加熱至140℃ | |
| B. | 濃硫酸和苯的混和液加熱至80℃ | |
| C. | 煮沸氯乙烷和苛性鉀溶液 | |
| D. | 煮沸氯乙烷和苛性鉀的醇溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com