
【題目】三草酸合鐵酸鉀晶體(K3[Fe(C2O4)3]xH2O)(其中鐵的化合價為+3價)是一種光敏材料,在110℃可完全失去結晶水。為測定該晶體中鐵的含量和結晶水的含量,某實驗小組做了如下實驗:
Ⅰ.鐵含量的測定
步驟1:稱量5.00g三草酸合鐵酸鉀晶體,配制成250mL溶液。
步驟2:取溶液25..00mL于錐形瓶中,酸化,滴加KMnO4溶液至草酸根(C2O42﹣)恰好全部被氧化成CO2,同時,MnO4﹣被還原成Mn2+;向反應后的溶液中加入鋅粉至黃色剛好消失,過濾,洗滌,將過濾及洗滌所得溶液收集到錐形瓶中,此時,溶液仍呈酸性。
步驟3:用0.010mol/LKMnO4溶液滴定步驟2所得溶液至終點,消耗KMnO4溶液20.02mL,滴定中MnO4﹣被還原成Mn2+。
重復步驟2、步驟3操作,滴定消耗0.010mol/LKMnO4溶液19.98mL。
請回答下列問題:
(1)步驟2中加入鋅粉至黃色剛好消失,目的是_____。
(2)寫出步驟3中發生反應的離子方程式_____。
(3)根據實驗數據,測得該晶體中鐵元素的質量分數為_____。
(4)若步驟2中加入的KMnO4溶液的量不足,則測得的鐵含量_____(選填“偏低”“偏高”或“不變”)
Ⅱ.結晶水的測定
(5)采用熱重分析儀測定三草酸合鐵酸鉀晶體K3[Fe(C2O4)3]xH2O在110℃時的失重率為a%,則晶體
化學式中結晶水個數x的計算式為_____。(用含a的代數式表示)(已知:三草酸合鐵酸鉀的摩爾質量M(K3[Fe(C2O4)3])=437g/mol)
【答案】將Fe3+恰好還原成Fe2+ 5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O 11.2% 偏高 ![]()
【解析】
(1)鋅粉具有還原性,加入鋅粉的目的是將Fe3+恰好還原成Fe2+;
(2)Fe2+被高錳酸鉀溶液氧化成Fe3+;
(3)根據5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O,計算鐵元素的質量分數;
(4)若在步驟二中滴入酸性高錳酸鉀溶液不足,則會有部分草酸根離子未被氧化,在步驟三中會繼續消耗酸性高錳酸鉀;
(5)由失重率為a%可知,晶體中水的質量分數是a%。
(1)鋅粉具有還原性,加入鋅粉的目的是將Fe3+恰好還原成Fe2+,使得步驟三的反應得以進行并測定鐵的含量;
(2)Fe2+被氧化成Fe3+,MnO4﹣被還原成Mn2,反應方程式為:5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O;
(3)根據離子方程式計算,n(Fe)=5n(MnO4﹣)=5×![]() ×0.01 molL﹣1×10﹣3×10=1.0×10﹣2mol,m(Fe)=56 gmol﹣1×1.0×10﹣2mol=0.56g,晶體中鐵的質量分數為:w(Fe)=
×0.01 molL﹣1×10﹣3×10=1.0×10﹣2mol,m(Fe)=56 gmol﹣1×1.0×10﹣2mol=0.56g,晶體中鐵的質量分數為:w(Fe)=![]() ×100%=11.2%;
×100%=11.2%;
(4)若在步驟二中滴入酸性高錳酸鉀溶液不足,則會有部分草酸根離子未被氧化,在步驟三中則會造成消耗酸性高錳酸鉀溶液的量偏大,從而計算出的鐵的量增多,含量偏高;
(5)由失重率為a%可知:![]() =a%,解得:x=
=a%,解得:x=![]() 。
。


 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:高中化學 來源: 題型:
【題目】ClO2是一種消毒殺菌效率高、二次污染小的水處理劑。實驗室可通過以下反應制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列說法不正確的是
2ClO2↑+K2SO4+2CO2↑+2H2O。下列說法不正確的是
A. KClO3在反應中得到電子 B. ClO2是還原產物
C. H2C2O4發生氧化反應 D. 1 molKClO3參加反應有2mol電子轉移
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】大氣污染物主要成分是SO2、NO2、NO、CO及可吸入顆粒等,主要來自于燃煤、機動車尾氣和工業廢氣,會導致霧霾、酸雨等。
(1)汽車的三元催化轉化器中,在催化劑作用下NO和CO轉化為無毒氣體,反應的化學方程式是: 2CO+2NO ![]() 2CO2+N2,該反應中,氧化劑是____________(填化學式),氧化產物是______________(填化學式),當生成2mol N2時,轉移電子的物質的量是____________________。
2CO2+N2,該反應中,氧化劑是____________(填化學式),氧化產物是______________(填化學式),當生成2mol N2時,轉移電子的物質的量是____________________。
(2)以NaClO溶液作為吸收劑進行一體化“脫硫”、“脫硝”。控制溶液的pH=5.5,將煙氣中的SO2轉化為SO42―。已知0.1mol/L 100mLNaClO溶液,可以恰好吸收0.01moL SO2,則反應的離子方程式是______________________。
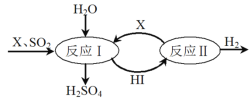
(3)SO2通過如圖過程既能制得H2SO4又能制得H2。圖中可循環利用的物質X是_________(填化學式),制得H2SO4的化學方程式是__________________________。
(4)用氫氧化鈉溶液可以吸收廢氣中的氮氧化物,反應的化學方程式如下:NO2+NO+2NaOH===2NaNO2+H2O 2NO2+2NaOH===NaNO2+NaNO3+H2O
現有V L某NaOH溶液能完全吸收n mol NO2和m mol NO組成的大氣污染物。所用燒堿溶液的物質的量濃度至少為________ mol·L1。若所得溶液中c(![]() )∶c(
)∶c(![]() )=1∶9,則原混合氣體中NO2和NO的物質的量之比n∶m=____________________。
)=1∶9,則原混合氣體中NO2和NO的物質的量之比n∶m=____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將32.0g銅與60.0mL一定濃度的硝酸發生如下反應:Cu+4HNO3 = Cu(NO3)2+2NO2↑+2H2O;3Cu+8HNO3 = 3Cu(NO3)2+2NO↑+4H2O。銅完全溶解產生的混合氣體體積為8.96L(標況)。請計算(各數據保留兩位有效數字):
(1)NO的體積為______
(2)該混合氣體的平均摩爾質量約為______
(3)待產生的氣體全部釋放后,向溶液加入100mL 2.0mol/L的NaOH溶液,恰好使溶液中的Cu2+全部轉化成沉淀,則原硝酸溶液的濃度為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將3.6 g鎂鋁合金,投入到500 mL 2 mol/L的鹽酸中,合金完全溶解,再加入4 mol/L的NaOH溶液,若要生成的沉淀最多,加入的這種NaOH溶液的體積是( )
A.150 mLB.200 mLC.250 mLD.280 mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
(1)寫出下列儀器的名稱:
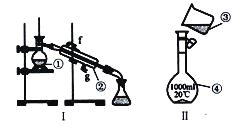
①__________________;②__________________;④__________________;
(2)儀器①~④中,使用時必須檢査是否漏水的有_______________(填序號〉
(3)現需配制250 mL0.2mol/LNaCl溶液,裝置II是某同學轉移溶液的示意圖,圖中兩處錯誤是_____________,___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組將純凈的SO2氣體緩緩的通入到盛有25mL0.1mol· L-1的Ba(NO3)2溶液中,得到BaSO4沉淀。為探究該反應中的氧化劑,該小組提出了如下假設:
假設Ⅰ:溶液中的NO3-;
假設Ⅱ:________________。
(1)該小組設計了以下實驗驗證了假設Ⅰ成立(為排除假設Ⅱ對假設Ⅰ的干擾,在配制下列實驗所用溶液時,應___________________),請填寫下表。
實驗步驟 | 實驗現象 | 結論 | |
實驗① | 向盛有25mL0.1mol·L-1BaCl2溶液的燒杯中緩慢通入純凈的SO2氣體 | ______ | 假設Ⅰ成立 |
實驗② | 向盛有25mL0.1mol· L-1Ba(NO3)2溶液的燒杯中緩慢通入純凈的SO2氣體 | ______ | |
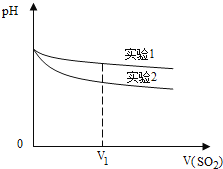
(2)為深入研究該反應,該小組還測得上述兩個實驗中溶液的pH隨通入SO2體積的變化曲線如圖。V1時,實驗②中溶液pH小于實驗①的原因是(用離子方程式表示):________。
(3)驗證假設Ⅱ。某同學設計了以下方案,請完成下列表格(可以不填滿)。
實驗步驟 | 實驗現象 | 實驗目的 | ||
實驗③ | 同實驗①步驟 | 同實驗①的相關現象 | ______ | |
實驗④ | ______ | ______ | ______ | |
(4)查資料知:H2SO3是二元酸(Kl=1.54×10-2,K2=1.02×10-7),請設計實驗方案驗證H2SO3是二元酸______(試劑及儀器自選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列是某興趣小組根據課本實驗設計的一個能說明Na2CO3與NaHCO3熱穩定性的套管實驗。請觀察下圖的實驗裝置、分析實驗原理,下列說法錯誤的是( )

A. 甲為小蘇打,乙為純堿
B. 要證明NaHCO3受熱能產生水,可在小試管內塞上沾有無水硫酸銅粉末的棉花球
C. 整個實驗過程中可以看到丙燒杯的澄清石灰水沒變渾濁
D. 同質量的甲和乙分別與足量的鹽酸完全反應,產生二氧化碳的質量:乙>甲
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究![]() 等大氣污染氣體的處理具有重要意義。
等大氣污染氣體的處理具有重要意義。
(1)已知:![]() ;
;![]() ;
;
則反應![]() 的
的![]() =________。
=________。
(2)一定條件下,將![]() 與
與![]() 以體積比
以體積比![]() 置于密閉容器中發生上述反應,測得上述反應平衡時
置于密閉容器中發生上述反應,測得上述反應平衡時![]() 與
與![]() 體積比為
體積比為![]() ,則平衡常數
,則平衡常數![]() =________(保留兩位小數)。
=________(保留兩位小數)。
(3)![]() 可用于合成甲醇,反應方程式為
可用于合成甲醇,反應方程式為![]() 。
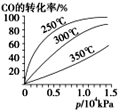
。![]() 在不同溫度下的平衡轉化率與壓強的關系如圖所示。該反應
在不同溫度下的平衡轉化率與壓強的關系如圖所示。該反應![]() ________
________![]() (填“>”或“<”)。實際生產條件控制在
(填“>”或“<”)。實際生產條件控制在![]() 、
、![]() 左右,選擇此壓強的理由是__________________。
左右,選擇此壓強的理由是__________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com