
Ⅰ.含氮化合物西瓜膨大劑別名氯吡苯脲,是經過國家批準的植物生長調節劑,實踐證明長期使用對人體無害。已知其相關性質如下表所示:
|
分子式 |
結構簡式 |
外觀 |
熔點 |
溶解性 |
|
C12H10ClN3O |
|
白色結晶粉末 |
170~172℃ |
易溶于水 |
(1)氯吡苯脲的晶體類型為_______ ,所含第二周期元素第一電離能從大到小的順序為
________________(用元素符號表示)。
(2)氯吡苯脲熔點低,易溶于水的原因分別為 _ 。
(3)查文獻可知,可用2-氯-4-氨基吡啶與異氰酸苯酯反應,生成氯吡苯脲。
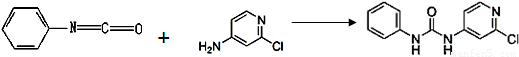
異氰酸苯酯 2-氯-4-氨基吡啶 氯吡苯脲
反應過程中,每生成1mol氯吡苯脲,斷裂_______個σ鍵、斷裂_______個π鍵。
(4)含氮的化合物氨氣水溶液逐滴加入硝酸銀溶液中制備銀氨溶液,寫出銀氨溶液的配制過程中沉淀溶解的離子方程式 。
Ⅱ.下列是部分金屬元素的電離能
|
|
X |
Y |
Z |
|
第一電離能(kJ/mol) |
520.2 |
495.8 |
418.8 |
(5)已知X、Y、Z的價層電子構型為ns1,則三種金屬的氯化物(RCl)的熔點由低到高的順序為:
。
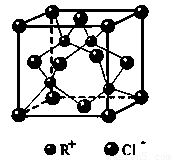
(6)RCl可用作有機合成催化劑, 并用于顏料, 防腐等工業。R+中所有電子正好充滿K、L、M 三個電子層,它與Cl-形成的晶體結構如下圖所示。元素R基態原子的電子排布式 _ ,
與同一個Cl-相連的 R+有 個。
(1)分子晶體; N>O>C (各2分共4分)
(2)氯吡苯脲是分子晶體,故熔點低;氯吡苯脲與水分子間形成氫鍵,故易溶于水。(各1分,共2分) (3)NA(或6.02×1023) NA(或6.02×1023)(各1分,共2分)
(4)AgOH +2 NH3·H2O=〔Ag(NH3)2〕OH + 2H2O
(或者AgOH +2 NH3·H2O + NH4NO3=〔Ag(NH3)2〕NO3 +2 H2O) (3分)
(5)ZCl<YCl<XCl (2分) (6)Cu 1s22s22p63s23p63d104s1 或[Ar] 3d104s1(2分); 4(2分)
【解析】
試題分析:(1)氯吡苯脲的熔點較低,易溶于水,所以其晶體類型是分子晶體。其中所含第二周期元素分別是C、N、O,非金屬性越強,第一電離能越大,但由于氮元素的2p軌道電子處于半充滿狀態,穩定性強,所以第一電離能大于氧元素的,即正確的順序是N>O>C。
(2)由于氯吡苯脲是分子晶體,故熔點低;N與O元素的非金屬性較強,因此氯吡苯脲與水分子間形成氫鍵,所以易溶于水。
(3)由于單鍵都是σ鍵、而雙鍵是由1個σ鍵和1個π鍵構成的,所以根據反應的方程式可知,每生成1mol氯吡苯脲,斷裂NA個σ鍵和NA個π鍵。
(4)X、Y、Z的價層電子構型為ns1,則這三種元素都屬于第IA族元素.同一主族元素,元素的第一電離能隨著原子序數的增大而減小,根據表格知,X、Y、Z這三種元素的金屬性逐漸增強,原子半徑逐漸增大,這三種金屬的氯化物(RCl)都是離子晶體,離子晶體的熔點與離子半徑成反比,與電荷數成正比,X、Y、Z這三種陽離子電荷數相等,離子半徑逐漸增大,所以其熔點從小到大的順序是ZCl<YCl<XCl。
(5)R+中所有電子正好充滿K、L、M 三個電子層,則R的原子序數是2+8+18+1=29.銅是29號元素,則R是Cu。因此根據構造原理知其基態原子核外電子排布式為1s22s22p63s23p63d104s1 或[Ar]3d104s1。根據晶胞結構知,面心上的氯離子連接4個亞銅離子,所以與同一個Cl-相連的 R+有4個。
考點:考查晶體類型、性質、第一電離能、共價鍵、核外電子排布以及晶體結構的判斷等


湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com