
【題目】冶金工業、硝酸工業的廢氣廢液中含氮化合物污染嚴重,必須處理達標后才能排放。
Ⅰ.用活性炭處理工廠尾氣中的氮氧化物。
(1)已知:①4NH3(g)+5O2(g) =4NO(g)+6H2O(l) ΔH1=a kJ·mol1
②4NH3(g)+3O2(g) =2N2(g)+6H2O(l) ΔH2=b kJ·mol1
③C(s)+O2(g) =CO2(g) ΔH3=c kJ·mol1
則反應C(s)+2NO(g)![]() N2(g)+CO2(g)的ΔH=________。
N2(g)+CO2(g)的ΔH=________。
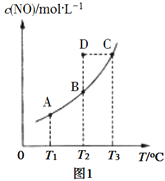
(2)在容積不變的密閉容器中,一定量的NO與足量的C發生反應:C(s)+2NO(g)![]() N2(g) + CO2(g) ΔH= Q kJ·mol1,平衡時c(NO)與溫度T的關系如圖1所示,下列說法正確的是________。
N2(g) + CO2(g) ΔH= Q kJ·mol1,平衡時c(NO)與溫度T的關系如圖1所示,下列說法正確的是________。
A.其他條件不變,改變活性炭的用量,平衡一定不移動
B.該反應的Q>0,所以T1、T2、T3對應的平衡常數:K1<K2<K3
C.溫度為T2時,若反應體系處于狀態D,則此時 υ(正)>υ(逆)
D.若狀態B、C、D體系的壓強分別為p(B)、p(C)、p(D),則p(D)=p(C)>p(B)
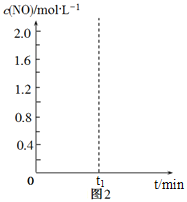
(3)已知某溫度時,反應C(s)+2NO(g)![]() N2(g)+CO2(g)的平衡常數K=
N2(g)+CO2(g)的平衡常數K=![]() ,在該溫度下的2L密閉容器中投入足量的活性炭和2.0 mol NO發生反應,t1時刻達到平衡,請在圖2中畫出反應過程中c(NO)隨時間t的變化曲線。_________________
,在該溫度下的2L密閉容器中投入足量的活性炭和2.0 mol NO發生反應,t1時刻達到平衡,請在圖2中畫出反應過程中c(NO)隨時間t的變化曲線。_________________
Ⅱ.用納米鐵粉或電解法處理廢水中的硝酸鹽。
(4)納米鐵粉處理污水中NO3的離子方程式為:4Fe+NO3–+10H+=4Fe2++NH4++3H2O。
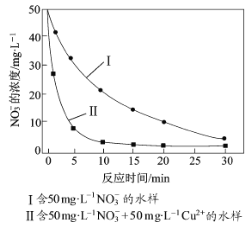
實驗證實,pH偏低將會導致NO3的去除率下降,其原因是________________。相同條件下,納米鐵粉去除不同水樣中NO3的速率有較大差異(見下圖),產生該差異的可能原因是________________________。
(5)電解法處理水中硝酸鹽的原理是:以金屬Pt作電極,用質子交換膜把溶液分為陰陽兩極區,陰極區為含硝酸鹽的工業廢水,接通直流電源進行電解,產物為N2。請寫出陰極的電極反應式____________。
【答案】 (![]() +c)kJ/mol C
+c)kJ/mol C  納米鐵粉與H+反應生成H2,導致NO3-的去除率下降 Cu或Cu2+對納米鐵粉去除NO3-的反應有催化作用(或形成Fe-Cu原電池增大納米鐵粉去除NO3-的反應速率) 2NO3-+10e-+12H+=N2↑+6H2O
納米鐵粉與H+反應生成H2,導致NO3-的去除率下降 Cu或Cu2+對納米鐵粉去除NO3-的反應有催化作用(或形成Fe-Cu原電池增大納米鐵粉去除NO3-的反應速率) 2NO3-+10e-+12H+=N2↑+6H2O
【解析】I.(1)應用蓋斯定律。
(2)A項,將C全部從平衡體系中移走,平衡逆向移動;B項,根據圖像,升高溫度c(NO)增大,平衡逆向移動,化學平衡常數減小,逆反應為吸熱反應,Q![]() 0;C項,狀態D的c(NO)大于T2平衡時c(NO),則狀態D反應正向進行,此時υ(正)
0;C項,狀態D的c(NO)大于T2平衡時c(NO),則狀態D反應正向進行,此時υ(正)![]() υ(逆);D項,該反應的正反應為氣體分子數不變的反應,氣體分子物質的量始終不變,在容積不變的密閉容器中體系的壓強取決于溫度,溫度越高壓強越大,則p(C)
υ(逆);D項,該反應的正反應為氣體分子數不變的反應,氣體分子物質的量始終不變,在容積不變的密閉容器中體系的壓強取決于溫度,溫度越高壓強越大,則p(C)![]() p(B)=p(D)。
p(B)=p(D)。
(3)用三段式和化學平衡常數計算平衡時c(NO)。
II.(4)pH偏低,溶液酸性較強,納米鐵粉與H+反應生成H2,導致NO3-的去除率下降。根據圖像,含Cu2+的水樣中NO3-的去除速率更快,產生差異的原因是:Cu或Cu2+對納米鐵粉去除NO3-的反應有催化作用(或形成Fe-Cu原電池增大納米鐵粉去除NO3-的反應速率)。
(5)根據題意,陰極NO3-得電子被還原成N2,2molNO3-得到10mol電子生成1molN2,結合質子交換膜和原子守恒書寫。
I.(1)應用蓋斯定律,將③-①![]() +②
+②![]() 得,C(s)+2NO(g)
得,C(s)+2NO(g)![]() N2(g)+CO2(g)ΔH=(c-
N2(g)+CO2(g)ΔH=(c-![]() +
+![]() )kJ/mol。
)kJ/mol。
(2)A項,將C全部從平衡體系中移走,平衡逆向移動,A項錯誤;B項,根據圖像,升高溫度c(NO)增大,平衡逆向移動,化學平衡常數減小,逆反應為吸熱反應,Q![]() 0且K1
0且K1![]() K2
K2![]() K3,B項錯誤;C項,狀態D的c(NO)大于T2平衡時c(NO),則狀態D反應正向進行,此時υ(正)
K3,B項錯誤;C項,狀態D的c(NO)大于T2平衡時c(NO),則狀態D反應正向進行,此時υ(正)![]() υ(逆),C項正確;D項,該反應的正反應為氣體分子數不變的反應,氣體分子物質的量始終不變,在容積不變的密閉容器中體系的壓強取決于溫度,溫度越高壓強越大,則p(C)
υ(逆),C項正確;D項,該反應的正反應為氣體分子數不變的反應,氣體分子物質的量始終不變,在容積不變的密閉容器中體系的壓強取決于溫度,溫度越高壓強越大,則p(C)![]() p(B)=p(D),D項錯誤;答案選C。
p(B)=p(D),D項錯誤;答案選C。
(3)用三段式,設從起始到平衡轉化c(NO)為xmol/L
C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
c(起始)(mol/L) 1.0 0 0
c(轉化)(mol/L) x ![]()
![]()
c(平衡)(mol/L) 1.0-x ![]()
![]()
化學平衡常數K=![]() =
=![]() =
=![]() ,解得x=0.6,作圖時,起始c(NO)為1.0mol/L,隨著時間推移c(NO)減小,t1達到平衡時c(NO)為1.0mol/L-0.6mol/L=0.4mol/L,t1后c(NO)保持0.4mol/L。
,解得x=0.6,作圖時,起始c(NO)為1.0mol/L,隨著時間推移c(NO)減小,t1達到平衡時c(NO)為1.0mol/L-0.6mol/L=0.4mol/L,t1后c(NO)保持0.4mol/L。
II.(4)pH偏低,溶液酸性較強,納米鐵粉與H+反應生成H2,導致NO3-的去除率下降。根據圖像,含Cu2+的水樣中NO3-的去除速率更快,產生差異的原因是:Cu(Fe與Cu2+反應生成Cu,反應的方程式為Fe+Cu2+=Fe2++Cu)或Cu2+對納米鐵粉去除NO3-的反應有催化作用(或形成Fe-Cu原電池增大納米鐵粉去除NO3-的反應速率)。
(5)根據題意,陰極NO3-得電子被還原成N2,2molNO3-得到10mol電子生成1molN2,結合質子交換膜和原子守恒,陰極的電極反應式為2NO3-+10e-+12H+=N2↑+6H2O。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下圖中A~H均為中學化學中常見的物質,A是黃綠色氣體、B、H是無色無味氣體。(反應中生成的水已略去)

請回答以下問題:
(1)A是________,H是________。(填化學式)
(2)C物質在日常生活中可作________劑。
(3)F分子所含共價鍵類型是________;寫出B的電子式_________。
(4)寫出反應①的化學方程式:____________________________;寫出反應③的離子方程式:____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化錳在生活和化學實驗中有廣泛應用。海底蘊藏著豐富的錳結核礦,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制備純凈的MnO2,其制備過程如下圖所示:

(1)步驟Ⅰ中,試劑甲必須具有的性質是________(填序號)。
A.堿性 B.穩定性 C.氧化性 D.還原性
(2)用惰性材料作電極,電解硫酸錳溶液制二氧化錳,寫出陽極反應式:_____________________。步驟Ⅲ中,以KClO3為氧化劑,當生成0.050 mol MnO2時,消耗0.10 mol·L-1的KClO3溶液200 mL,該反應的離子方程式為____________________________________________。
(3)用100 mL 12.0 mol·L-1的濃鹽酸與足量MnO2混合后,加熱,反應產生的氯氣在標準狀況下體積范圍為________________。工業上可以用實驗室制氯氣的殘余物質溶液吸收氯氣,獲得Mn2O3,Mn2O3廣泛應用于電子工業、印染工業等領域。請寫出該化學反應的離子方程式:__________________。
(4)二氧化錳是實驗室制取氧氣的催化劑。下列是某同學設計實驗探究雙氧水分解實驗方案;
實驗 | 20.0 mL雙氧水溶液濃度 | 粉狀MnO2 | 溫度 | 待測數據 |
Ⅰ | 5% | 2.0 g | 20℃ | |
Ⅱ | 5% | 1.0 g | 20℃ | |
Ⅲ | 10% | 1.0 g | 20℃ | |
Ⅳ | ω | 2.0 g | 30℃ |
①實驗Ⅱ和Ⅲ的結論是____________________________________________________。
②利用實驗Ⅰ和Ⅳ探究溫度對化學反應速率的影響,w=________。本實驗待測數據是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的轉化在給定條件下均能通過一步反應實現的是
A. NaAlO2(aq) AlCl3
AlCl3![]() Al2O3B. NaCl(飽和)
Al2O3B. NaCl(飽和)![]() NaHCO3
NaHCO3![]() Na2CO3C. N2
Na2CO3C. N2 NO2
NO2![]() HNO3
HNO3
D. FeS2![]() SO3
SO3![]() H2SO4
H2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】據鳳凰網2018 年2 月1日報道:中科院研發出世界最強氘氚中子源,下列有關說法正確的是
A. 氘、氚是兩種不同的元素 B. 氘、氚的中子數分別為1、2
C. 氘、氚核外電子數不同 D. 中子帶正電
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E為短周期元素,在周期表中所處的位置如下圖所示。A、C兩種元素的原子核外電子數之和等于B原子的質子數,B原子核內質子數和中子數相等:
A | C | |
D | B | E |
(1)寫出三種元素名稱A________、B _______、C_______。
(2)B元素位于元素周期表中第______周期,_______族。
(3)比較B、D、E三種元素的最高價氧化物的水化物酸性最強的是(用化學式表示)______。
(4)C原子結構示意圖為________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的產物中,有的有同分異構體,有的沒有同分異構體,其中一定不存在同分異構體的反應是
A.異戊二烯(![]() )與等物質的量的Br2發生加成反應
)與等物質的量的Br2發生加成反應
B.2氯丁烷與NaOH乙醇溶液共熱發生消去HCl分子的反應
C.甲苯在一定條件下發生硝化反應生成一硝基甲苯的反應
D.鄰羥基苯甲酸與NaHCO3溶液反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】砷化鎵是繼硅之后研究最深入、應用最廣泛的半導體材料。回答下列問題:
(1)Ga基態原子核外電子排布式為__________________,As基態原子核外有____個未成對電子。
(2)Ga、As、Se的第一電離能由大到小的順序是___________,Ga、As、Se的電負性由大到小的順序是_________________。
(3)比較下列鎵的鹵化物的熔點和佛點,分析其變化規律及原因:_________________。
鎵的鹵化物 | GaI3 | GaBr3 | GaCl3 |
熔點/℃ | 77.75 | 122.3 | 211.5 |
沸點/℃ | 201.2 | 279 | 346 |
GaF3的熔點超過1000℃,可能的原因是______________。
(4)二水合草酸鎵的結構如圖1所示,其中鎵原子的配位數為___________,草酸根中碳原子的雜化軌道類型為______________。

(5)砷化鎵的立方晶胞結構如圖2所示,晶胞參數為a=0.565nm,砷化鎵晶體的密度為_____g/cm3(設NA為阿伏加德羅常數的值,列出計算式即可)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com