
| A. | 常溫下,NO分解產生O2的反應平衡常數表達式為K1=[N2][O2] | |
| B. | 常溫下,水分解產生O2,此時平衡常數的數值約為5×10-80 | |
| C. | 常溫下,NO、H2O、CO2三種化合物分解放出O2的傾向由大到小的順序為NO>H2O>CO2 | |
| D. | 以上說法都不正確 |
分析 A.化學平衡常數是指生成物的濃度冪之積除以反應物的濃度冪之積的數值;
B.根據方程式的書寫反寫,平衡常數是原來的倒數;
C.根據化學平衡常數K的數值越大,化學反應進行的程度越大;
D.根據ABC選項的情況回答.
解答 解:A.常溫下,NO分解產生O2的反應的平衡常數表達式式K1=$\frac{c(N{\;}_{2})•c(O{\;}_{2})}{c{\;}^{2}(NO)}$,故A錯誤;
B.2H2(g)+O2(g)?2H2O(g) K2=2×1081,所以2H2O(g)?2H2(g)+O2(g) K=$\frac{1}{2×10{\;}^{81}}$=5×10-82,故B錯誤;
C.由2H2O(g)?2H2(g)+O2(g) K=5×10-82,則常溫下,NO、H2O、CO2三種化合物分解放出O2的化學平衡常數K的數值逐漸減少,則化學反應進行傾向由大到小的順序為NO>H2O>CO2,故C正確;
D.因C正確,故D錯誤;
故選:C.
點評 本題考查的是化學平衡常數的相關知識,化學平衡常數是指生成物的濃度冪之積除以反應物的濃度冪之積的數值.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 壓強/MPa C% 速度/℃ | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.2 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
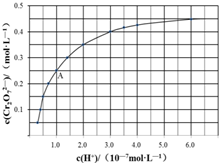 元素鉻(Cr)在溶液中主要以Cr3+(藍紫色)、Cr(OH)4-(綠色)、Cr2O72-(橙紅色)、CrO42-(黃色)等形式存在,Cr(OH)3為難溶于水的灰藍色固體,回答下列問題:
元素鉻(Cr)在溶液中主要以Cr3+(藍紫色)、Cr(OH)4-(綠色)、Cr2O72-(橙紅色)、CrO42-(黃色)等形式存在,Cr(OH)3為難溶于水的灰藍色固體,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
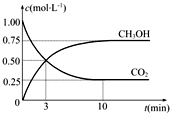 “低碳循環”引起各國的高度重視,已知煤、甲烷等可以與水蒸氣反應生成以CO和H2為主的合成氣,合成氣有廣泛應用.試回答下列問題:
“低碳循環”引起各國的高度重視,已知煤、甲烷等可以與水蒸氣反應生成以CO和H2為主的合成氣,合成氣有廣泛應用.試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
 ,含有的化學鍵類型離子鍵和共價鍵,Z2Y2為離子晶體.
,含有的化學鍵類型離子鍵和共價鍵,Z2Y2為離子晶體.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com