
【題目】本題為選做題,包括A、B兩題。選學《化學與生活》模塊的考生答A題,選學《有機化學基礎》模塊的考生答B題,每位考生只可選做1題。若兩題都作答,則以A題計分。
A. 《化學與生活》

(1) 營養均衡是保證健康的重要方面。某種食品的配料標簽如圖所示,根據該食品的配料填空。
①該食品配料中,富含糖類的物質是____。
②該食品配料中,苯甲酸鈉的作用是____。
③該食品配料中,碳酸氫鈉的作用是____。
(2) 材料是社會經濟發展的物質基礎。
①鋼鐵在生活中的應用十分廣泛,在潮濕的空氣中容易發生____腐蝕。
②普通玻璃的主要成分是Na2SiO3、CaSiO3和 ____(填化學式)。____(填化學式)對玻璃有腐蝕作用,可用于在玻璃儀器上標注刻度及文字。
③聚氯乙烯塑料的結構簡式為________,玻璃鋼屬于________(填“無機非金屬材料”“功能高分子材料”或“復合材料”)。
(3)化學與技術的發展是解決環境問題的有效路徑。
①減少燃煤產生氣體SO2的排放,能夠有效控制______(填“硝酸型酸雨”“硫酸型酸雨”或“光化學煙霧”)的形成;向燃煤中加入適量的____(填名稱)可減少燃煤煙氣中的SO2排放。
②燃煤產生的CO2用氨水吸收可得到氮肥碳銨(NH4HCO3),寫出該反應的化學方程式______________。工業上通常采用沉淀法除去廢水中的重金屬離子,需要控制廢水的_____使重金屬離子以氫氧化物的形式沉淀出來。
③工業上采用將CO在500 ℃、鋁礬催化作用下還原SO2,反應得到兩種產物,其中一種產物在常溫下是固體。該項技術可大大降低燃煤煙氣中SO2的含量,反應的化學方程式為____________________。
B.《有機化學基礎》
(1) 有機物的結構決定了其所具有的性質。
①下列有機物不溶于水的是____(填字母)。
a. 乙醛 b. 乙醇 c. 乙酸乙酯
②下列化合物中,不能與新制氫氧化銅懸濁液反應的是____(填字母)。
a. 福爾馬林 b. 乙烯 c. 乙酸
③下列試劑中,可用于鑒別苯和甲苯的是____(填字母)。
a. 水 b. 溴水 c. 酸性KMnO4溶液
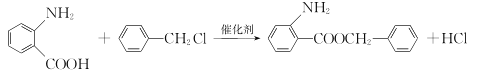
(2)水楊酸是一種柳樹皮提取物,是天然的消炎藥,其結構為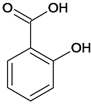 。
。
①水楊酸苯環上的一氯代物有____種。
②水楊酸需密閉保存,其原因是__________。
③水楊酸與足量NaHCO3溶液反應,所得有機產物的結構簡式為______。
(3)化合物C是一種醫藥中間體,由甲苯制備化合物C的路線如下:
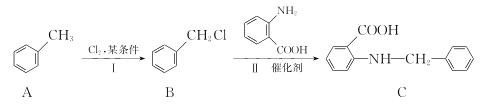
①A→B的反應類型是____。
②B分子中化學環境不同的氫原子有____種。
③D是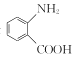 的一種同分異構體,D分子中只有一種官能團,苯環上的一氯代物有2種。則D的結構簡式為________。
的一種同分異構體,D分子中只有一種官能團,苯環上的一氯代物有2種。則D的結構簡式為________。
④B→C的反應中能生成化合物E,E和C的相對分子質量相同,寫出生成化合物E的化學方程式_______________________。
【答案】小麥粉 防腐劑 疏松劑 電化學 SiO2 HF ![]() 復合材料 硫酸型酸雨 石灰石(或石灰或生石灰) CO2+NH3+H2O===NH4HCO3 pH(酸度、酸堿度) 2CO+SO2
復合材料 硫酸型酸雨 石灰石(或石灰或生石灰) CO2+NH3+H2O===NH4HCO3 pH(酸度、酸堿度) 2CO+SO2![]() S+2CO2 c b c 4 容易被空氣中的氧氣氧化
S+2CO2 c b c 4 容易被空氣中的氧氣氧化 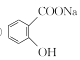 取代反應 4
取代反應 4 
【解析】
A(1)熟記人體必需的六大營養素以及富含各類營養素的食物、食品添加劑及其作用;
(2)熟記各種材料的組成、性質、及應用。
(3)根據污染物的組成、性質、污染的處理方法來分析。
B(1)根據有機物的結構分析性質。
(2)根據水楊酸的結構分析。
(3)①甲苯側鏈上的氫被氯原子取代;
②B分子中苯環上有3種氫,側鏈上有1種,B分子中化學環境不同的氫原子有4種;
③D是 的一種同分異構體,D分子中只有一種官能團,有N和O原子的應為硝基,苯環上的一氯代物有2種,說明結構對稱。
的一種同分異構體,D分子中只有一種官能團,有N和O原子的應為硝基,苯環上的一氯代物有2種,說明結構對稱。
④B和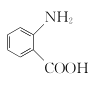 的羧基之間發生取代反應。
的羧基之間發生取代反應。
A(1)①該食品配料中,富含糖類的物質是小麥粉。
②該食品配料中,苯甲酸鈉的作用是防腐劑。
③該食品配料中,碳酸氫鈉的作用是疏松劑。
(2) ①鋼鐵中碳、鐵、在潮濕的空氣中易形成原電池,發生電化學腐蝕;
②普通玻璃的主要成分是Na2SiO3、CaSiO3和 SiO2;4HF+SiO2=SiF4+2H2O,HF(填化學式)對玻璃有腐蝕作用,可用于在玻璃儀器上標注刻度及文字。
③CH2=CHCl聚合生成聚氯乙烯塑料,結構簡式為![]() ,玻璃鋼(FRP)亦稱作GFRP,即纖維強化塑料,一般指用玻璃纖維增強不飽和聚酯、環氧樹脂與酚醛樹脂基體。以玻璃纖維或其制品作增強材料的增強塑料,稱謂為玻璃纖維增強塑料,或稱為玻璃鋼,不同于鋼化玻璃。玻璃鋼屬于復合材料。
,玻璃鋼(FRP)亦稱作GFRP,即纖維強化塑料,一般指用玻璃纖維增強不飽和聚酯、環氧樹脂與酚醛樹脂基體。以玻璃纖維或其制品作增強材料的增強塑料,稱謂為玻璃纖維增強塑料,或稱為玻璃鋼,不同于鋼化玻璃。玻璃鋼屬于復合材料。
(3)①SO2排放到空氣中易形成酸雨,減少燃煤產生氣體SO2的排放,能夠有效控制硫酸型酸雨的形成;石灰石(或石灰或生石灰)能與SO2作用生成CaSO4,從而可減少燃煤煙氣中的SO2排放。
②CO2用氨水吸收可得到氮肥碳銨(NH4HCO3),方程式為CO2+NH3+H2O=NH4HCO3;重金屬離子的氫氧化物溶解度一般比較小,控制廢水的pH(酸度、酸堿度)可使重金屬離子以氫氧化物的形式沉淀出來。
③工業上采用將CO在500 ℃、鋁礬催化作用下還原SO2,反應得到兩種產物,其中一種產物在常溫下是固體,SO2還原后得到固體只能是S,反應的化學方程式為2CO+SO2![]() S+2CO2 。
S+2CO2 。
B①乙醛、乙醇均易溶于水,乙酸乙酯難溶于水,故選c;
②福爾馬林是甲醛的水溶液,能與新制氫氧化銅懸濁液反應,乙酸含有羧基能與新制氫氧化銅懸濁液反應,故選b;
③苯和甲苯均難溶于水,密度均比水小;苯和甲苯均能萃取溴水中有溴,甲苯能使酸性KMnO4溶液褪色,苯不能,故選c;
(2)①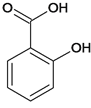 苯環上有4種不同的氫,水楊酸苯環上的一氯代物有4種;
苯環上有4種不同的氫,水楊酸苯環上的一氯代物有4種;
②水楊酸需密閉保存,其原因是酚羥基容易被空氣中的氧氣氧化;
③酸性-COOH>碳酸>酚羥基>HCO3-,水楊酸與足量NaHCO3溶液反應,只有羧基反應,所得有機產物的結構簡式為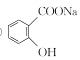 ;
;
(3)①甲苯側鏈上的氫被氯原子取代,A→B的反應類型是取代反應;
②B分子中苯環上有3種氫,側鏈上有1種,B分子中化學環境不同的氫原子有4種;
③D是 的一種同分異構體,D分子中只有一種官能團,有N和O原子的基團應為硝基,苯環上的一氯代物有2種,說明結構對稱,則D的結構簡式為
的一種同分異構體,D分子中只有一種官能團,有N和O原子的基團應為硝基,苯環上的一氯代物有2種,說明結構對稱,則D的結構簡式為 。
。
④B→C的反應中能生成化合物E,E和C的相對分子質量相同,B和 的羧基之間發生取代反應,方程式為
的羧基之間發生取代反應,方程式為


 暑假接力賽新疆青少年出版社系列答案
暑假接力賽新疆青少年出版社系列答案科目:高中化學 來源: 題型:
【題目】向NaOH和NaAlO2混合溶液中滴加NaHCO3溶液,測得溶液pH和Al(OH)3生成的量隨加入NaHCO3溶液體積的變化情況如圖所示。下列說法不正確的是
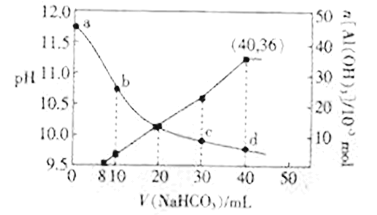
A. 加入的NaHCO3先與NaOH反應
B. b點和c點均有c(Na+)<2c(CO32-)+c(HCO3-)
C. NaHCO3溶液的物質的量濃度為1.125 mol·L-1
D. d點時:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為電解飽和食鹽水裝置,下列有關說法不正確的是

A. 左側電極上發生氧化反應
B. 右側生成的氣體能使濕潤的淀粉碘化鉀試紙變藍
C. 電解一段時間后,B口排出NaOH溶液
D. 電解飽和食鹽水的離子方程式: 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式,書寫正確的是( )
A.鹽酸與石灰石反應:CO32ˉ+2H+ = CO2↑+H2O
B.鐵與稀鹽酸反應:2Fe+6H+ = 2Fe3++3H2↑
C.氫氧化鐵膠體的制備:FeCl3 + 3H2O = Fe(OH)3+3HCl
D.硫酸銅溶液中滴加氫氧化鋇溶液:Ba2++2OH-+Cu2++SO42ˉ = BaSO4↓+Cu(OH)2↓
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】離子的摩爾電導率可用來衡量電解質溶液中離子導電能力的強弱,摩爾電導率越大,離子在溶液中的導電能力越強。已知Ca2+、OH-、HCO3—的摩爾電導率分別為0.60、1.98、0.45,據此可判斷,向飽和的澄清石灰水中通入過量的二氧化碳,溶液導電能力隨二氧化碳通入量的變化趨勢正確的是( )
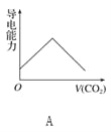
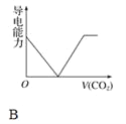

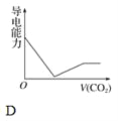
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按以下裝置圖進行實驗,填寫有關現象及化學方程式。

(1)A中現象是____________________,
(2)B中濃硫酸的作用是_______________
(3)C中發生反應的化學方程式為______________,
(4)D中現象是_______________;反應的離子方程式是__________________________,
E中收集的氣體是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)鐵釘在氯氣中被銹蝕為棕黃色物質![]() ,而在鹽酸中生成淺綠色的
,而在鹽酸中生成淺綠色的![]() 溶液。則在
溶液。則在![]() 、
、![]() 、
、![]() 中,具有氧化性的是_____________________。
中,具有氧化性的是_____________________。
(2)鹽酸在不同的反應中,可以分別表現出酸性、氧化性和還原性。現有如下四個反應,請寫出鹽酸在四個反應中,分別表現什么性質。
①![]() ________________________;
________________________;
②![]() ________________________;
________________________;
③![]() ________________________;
________________________;
④![]() ________________________。
________________________。
(3)用雙線橋表示此氧化還原反應:![]() _____________________
_____________________
(4)題(2)的反應④中氧化劑與還原劑的物質的量之比為________,若有5 mol還原劑被氧化,則轉移的電子數為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅在生活中有廣泛的應用。CuCl2和CuCl是兩種常見的鹽,廣泛應用于工業生產。
I. CuCl2固體遇水易水解。實驗室用如圖所示的實驗儀器及藥品來制備純凈、干燥的氯氣,并與粗銅(含雜質鐵)反應制備氯化銅(鐵架臺、鐵夾及酒精燈省略)。

(1)寫出裝置A中,發生反應的化學反應方程式:____,裝置C的作用是____
(2)完成上述實驗,按氣流方向連接各儀器接口的順序是a→___。(每種儀器限使用一次)
(3)上述D裝置的作用是____
Ⅱ. CuCl是應用廣泛的有機合成催化劑,可采取不同方法制取。CuCl晶體呈白色,露置于潮濕空氣中易被氧化。
方法一:向上述制得的氯化銅溶液中通入SO2,加熱一段時間即可制得CuCl,寫出該反應的離子方程式:___。
方法二:銅粉還原CuSO4溶液
![]()
已知:CuCl難溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+2Cl-![]() [CuCl3]2-(無色溶液)。
[CuCl3]2-(無色溶液)。
(1)①中,“加熱”溫度不宜過高和過低,目的是___,當觀察到__現象,即表明反應已經完全。
(2)②中,加入大量水的作用是___。(從平衡角度解釋)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com