
| A | B | C |
| D | E | F |
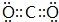 .
.分析 由短周期元素相對位置,可知A、B、C處于第二周,D、E、F處于第三周期,E元素原子核外電子總數是其最外層電子數的3倍,設核外最外層電子數為x,則有(2+8+x)=3x,解得x=5,則E為P元素,可知A為碳元素,B為N元素,C為O元素,D為Si,F為S元素.
解答 解:由短周期元素相對位置,可知A、B、C處于第二周,D、E、F處于第三周期,E元素原子核外電子總數是其最外層電子數的3倍,設核外最外層電子數為x,則有(2+8+x)=3x,解得x=5,則E為P元素,可知A為碳元素,B為N元素,C為O元素,D為Si,F為S元素.
(1)這六種元素中O元素非金屬性最強,故氫化物中,最穩定的是H2O,故答案為:H2O;
(2)CO2的電子式為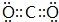 ,故答案為:
,故答案為: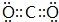 ;
;
(3)在一定條件下,由氮氣與H2反應生成1molG(氨氣)時,放出的熱量為46.2kJ,該反應的熱化學方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol,
故答案為:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol;
(4)工業上用G(氨氣)檢驗輸送氯氣的管道是否漏氣,可觀察到大量白煙,同時有單質B生成,反應生成氯化銨與氮氣,反應方程式為:8NH3+3Cl2═6NH4Cl+N2,反應中被氧化的氨氣與參與反應的氨氣的質量之比為2:8=1:4,
故答案為:8NH3+3Cl2═6NH4Cl+N2;1:4;
(5)F(硫)的單質可由其氧化物與氫化物反應生成,該反應的化學方程式:2H2S+SO2=3S↓+2H2O,
故答案為:2H2S+SO2=3S↓+2H2O.
點評 本題考查結構性質位置關系應用,熟練掌握元素周期表的結構,注意對基礎知識的理解掌握.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | K+、Na+、HCO3-、Cl- | B. | K+、AlO2-、Br-、Cl- | ||
| C. | Na+、Cl-、NO3-、SO42- | D. | Al3+、NH4+、Cl-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子最外層電子數等于或大于4的元素一定是非金屬元素 | |
| B. | 原子最外層只有2個電子的元素一定是金屬元素 | |
| C. | 最外層電子數比次外層電子數多的元素一定位于第二周期 | |
| D. | 某元素的離子最外層電子數與次外層電子數相同,該元素一定位于第三周期 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子化合物可能含共價鍵 | B. | 共價化合物可能含離子鍵 | ||
| C. | 離子化合物中只含離子鍵 | D. | 共價化合物中可能含共價鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na、Mg、Al還原性依次減弱 | B. | Cl2、Br2、I2氧化性依次增強 | ||
| C. | Be、Mg、Ca與鹽酸反應越來越劇烈 | D. | P、S、Cl最高正價依次升高 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學鍵 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
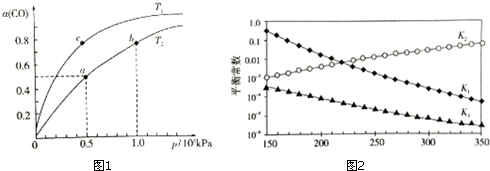
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 族 周期 | IA | IIA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
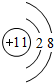 ,最活潑的非金屬元素是F (填元素符號,下同),Ar是最不活潑的元素.
,最活潑的非金屬元素是F (填元素符號,下同),Ar是最不活潑的元素.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
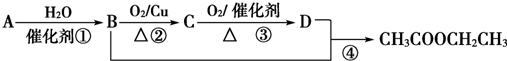
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | M>N | B. | M<N | C. | M=N | D. | 無法判斷 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com