
分析下列反應,指出氧化劑和氧化產物。
(1)2Na2O2+2SO2══2Na2SO3+O2__________________________________。
Na2O2+SO2══Na2SO4__________________________________________。
(2)6Na+2FeCl3+6H2O══2Fe(OH)3↓+6NaCl+3H2↑________________________。
(3)3Fe(s)+4H2O(g)══Fe3O4(s)+4H2(g)___________________________。
 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案科目:高中化學 來源: 題型:閱讀理解
| 催化劑 |
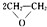
| ||
| ||
| 加熱、加壓 |
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空氣 |
| 反應條件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡轉化率 | 乙炔平衡轉化率90%左右 | 乙烯平衡轉化率80%左右 |
| 日產量 | 2.5噸(某設備條件下) | 3.6噸(相同設備條件下) |
| 原料生產工藝過程 | ||||||||
| 乙炔 | CaCO3
| |||||||
| 乙烯 | 來源于石油裂解氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(10分)溫家寶總理多次指出要大力抓好節能降耗、保護環境。請你分析并回答下列問題:
(1)“綠色化學”的最大特點在于它是在始端就采用預防實際污染的科學手段,因而過程和終端均為零排放和零污染,具有“原子經濟性”。下列化學反應不符合“綠色化學”思想的是 ____________________。
A.制備環氧乙烷:
B.制備硫酸銅Cu+2H2SO4CuSO4+SO2↑+2H2O
C.制備甲醇: 2CH4+O22CH3OH
D.制備硝酸銅:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金廢水中含有[Au(CN)2]-,其電離出的CN-有毒,當與H+結合生成HCN時,其毒性更強。工業上處理這種廢水是在堿性條件下,用NaClO將CN-氧化為CO32-和一種無毒氣體,該反應的方程式為 _____________________________,在酸性條件下,ClO-也能將CN-氧化,但實際處理時卻不在酸性條件下進行的主要原因是 ____________________________________________________________。
(3)工業上目前使用兩種方法制取乙醛——“乙炔水化法”和“乙烯氧化法”。下面兩表提供生產過程中原料、反應條件、原料平衡轉化率和產量等的有關信息:
|
| 乙炔水化法 | 乙烯氧化法 |
| 原料 | 乙炔、水 | 乙烯、空氣 |
| 反應條件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡轉化率 | 乙炔平衡轉化率90%左右 | 乙烯平衡轉化率80%左右 |
| 日產量 | 2.5噸(某設備條件下) | 3.6噸(相同設備條件下) |
表一:原料、反應條件、平衡轉化率、日產量
表二:原料來源生產工藝
|
| 原料生產工藝過程 |
| 乙炔 |
|
| 乙烯 | 來源于石油裂解氣 |
從兩表中分析,現代工業上“乙烯氧化法”將逐步取代“乙炔水化法”的可能原因。
①從產率和產量角度分析 。
②從環境保護和能耗角度分析 。
查看答案和解析>>
科目:高中化學 來源:2010年江蘇省啟東中學高一第二學期期中考試化學(實驗班)試題 題型:填空題
(10分)溫家寶總理多次指出要大力抓好節能降耗、保護環境。請你分析并回答下列問題:
(1)“綠色化學”的最大特點在于它是在始端就采用預防實際污染的科學手段,因而過程和終端均為零排放和零污染,具有“原子經濟性”。下列化學反應不符合“綠色化學”思想的是 ____________________。
A.制備環氧乙烷: |
B.制備硫酸銅Cu+2H2SO4 CuSO4+SO2↑+2H2O CuSO4+SO2↑+2H2O |
C.制備甲醇: 2CH4+O2 2CH3OH 2CH3OH |
| D.制備硝酸銅:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O |
| | 乙炔水化法 | 乙烯氧化法 |
| 原料 | 乙炔、水 | 乙烯、空氣 |
| 反應條件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡轉化率 | 乙炔平衡轉化率90%左右 | 乙烯平衡轉化率80%左右 |
| 日產量 | 2.5噸(某設備條件下) | 3.6噸(相同設備條件下) |
| | 原料生產工藝過程 |
| 乙炔 |   |
| 乙烯 | 來源于石油裂解氣 |
查看答案和解析>>
科目:高中化學 來源:2010年江蘇省高一第二學期期中考試化學(實驗班)試題 題型:填空題
(10分)溫家寶總理多次指出要大力抓好節能降耗、保護環境。請你分析并回答下列問題:
(1)“綠色化學”的最大特點在于它是在始端就采用預防實際污染的科學手段,因而過程和終端均為零排放和零污染,具有“原子經濟性”。下列化學反應不符合“綠色化學”思想的是 ____________________。
A.制備環氧乙烷:
B.制備硫酸銅Cu+2H2SO4 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
C.制備甲醇: 2CH4+O2 2CH3OH
2CH3OH
D.制備硝酸銅:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金廢水中含有[Au(CN)2]-,其電離出的CN-有毒,當與H+結合生成HCN時,其毒性更強。工業上處理這種廢水是在堿性條件下,用NaClO將CN-氧化為CO32-和一種無毒氣體,該反應的方程式為 _____________________________,在酸性條件下,ClO-也能將CN-氧化,但實際處理時卻不在酸性條件下進行的主要原因是 ____________________________________________________________。
(3)工業上目前使用兩種方法制取乙醛——“乙炔水化法”和“乙烯氧化法”。下面兩表提供生產過程中原料、反應條件、原料平衡轉化率和產量等的有關信息:
|
|
乙炔水化法 |
乙烯氧化法 |
|
原料 |
乙炔、水 |
乙烯、空氣 |
|
反應條件 |
HgSO4、100~125℃ |
PdCl2-CuCl2、100~125℃ |
|
平衡轉化率 |
乙炔平衡轉化率90%左右 |
乙烯平衡轉化率80%左右 |
|
日產量 |
2.5噸(某設備條件下) |
3.6噸(相同設備條件下) |
表一:原料、反應條件、平衡轉化率、日產量
表二:原料來源生產工藝
|
|
原料生產工藝過程 |
|
乙炔 |
|
|
乙烯 |
來源于石油裂解氣 |
從兩表中分析,現代工業上“乙烯氧化法”將逐步取代“乙炔水化法”的可能原因。
①從產率和產量角度分析 。
②從環境保護和能耗角度分析 。
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O 2CH3OH
2CH3OH| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空氣 |
| 反應條件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡轉化率 | 乙炔平衡轉化率90%左右 | 乙烯平衡轉化率80%左右 |
| 日產量 | 2.5噸(某設備條件下) | 3.6噸(相同設備條件下) |
| 原料生產工藝過程 | |
| 乙炔 | CaCO3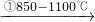 CaO CaO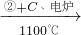 CaC2 CaC2 C2H2 C2H2 |
| 乙烯 | 來源于石油裂解氣 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com