
(10分)運用相關原理,回答下列各小題:
(1)常溫下,PH=5的溶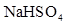 液中水的電離程度 PH=9的
液中水的電離程度 PH=9的 中水的電離程度。(填“>”、“=”或“<”)
中水的電離程度。(填“>”、“=”或“<”)
(2)等體積等物質的量濃度的 與氨水混合后,溶液呈酸性的原因為 。(用離子方程式表示);若一定量的
與氨水混合后,溶液呈酸性的原因為 。(用離子方程式表示);若一定量的 溶液與氨水混合后,溶液PH=7,則
溶液與氨水混合后,溶液PH=7,則
 (填“>”、“=”或“<”不同);用硫酸氫鈉與氫氧化鋇溶液制取硫酸鋇,若溶液中
(填“>”、“=”或“<”不同);用硫酸氫鈉與氫氧化鋇溶液制取硫酸鋇,若溶液中 完全沉淀,則反應后溶液的PH= 7(填“>”、”=”或“<”)
完全沉淀,則反應后溶液的PH= 7(填“>”、”=”或“<”)
(3)將分別含有 的四種溶液混合,調節溶液的PH值,使PH=1,充分反應后:①若
的四種溶液混合,調節溶液的PH值,使PH=1,充分反應后:①若 離子有剩余,上述四種離子在溶液中還存在的有 ,一定不存在的是
離子有剩余,上述四種離子在溶液中還存在的有 ,一定不存在的是
②若所得混合液呈紫色,上述四種離子在溶液中一定不存在的離子有 。
(1)= (1分)
(2)NH4++H2O NH3·H2O+H+
(2分)
NH3·H2O+H+
(2分)
=(1分) PH>7(1分)
(3)① (1分);
(1分); (2分);
(2分);
② (2分)
(2分)
【解析】
試題分析:(1)常溫下,PH=5的溶 液中水的電離的OH-為10-9mol/L,PH=9
液中水的電離的OH-為10-9mol/L,PH=9
 中水電離出的H+為10-9mol/L,兩者電離程度相同。
中水電離出的H+為10-9mol/L,兩者電離程度相同。
(2)溶液呈酸性是由于NH4+的水解,根據電荷守恒可得 =
= 
(3)將 的混合液調節至強酸性,若
的混合液調節至強酸性,若 離子有剩余,
離子有剩余, 已經沒有剩余,則還存在的是
已經沒有剩余,則還存在的是 ,所得混合液呈紫色,說明存在MnO4-,其具有氧化性,
,所得混合液呈紫色,說明存在MnO4-,其具有氧化性, 不能存在。
不能存在。
考點:弱電解質的電離和水解、離子共存、氧化還原反應
點評:電離程度就是分子在水中的電離的百分比;通常強酸弱堿鹽由于存在水解,而使溶液呈酸性。


科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| 化學式 | 電離常數 |
| HClO | Ka=3×10-8 |
| H2CO3 | Ka1=4.3×10-7 |
| Ka2=5.6×10-11 |
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
(14分)運用相關原理,回答下列各小題:
已知:![]() 在水中的電離方程式為
在水中的電離方程式為![]()
(1)常溫下,PH=5的![]() 溶液中水的電離程度 PH=9的
溶液中水的電離程度 PH=9的![]() 中水的電離程度。(填“>”、”=”或“<”)
中水的電離程度。(填“>”、”=”或“<”)
(2)等體積等物質的量濃度的![]() 與氨水混合后,溶液呈酸性的原因為 。(用離子方程式表示);若一定量的
與氨水混合后,溶液呈酸性的原因為 。(用離子方程式表示);若一定量的 溶液與氨水混合后,溶液PH=7,則
溶液與氨水混合后,溶液PH=7,則
![]()
![]() (填“>”、“=”或“<”不同);用硫酸氫鈉與氫氧化鈉溶液制取硫酸鋇,若溶液中
(填“>”、“=”或“<”不同);用硫酸氫鈉與氫氧化鈉溶液制取硫酸鋇,若溶液中![]() 完全沉淀,則反應后溶液的PH= 7(填“>”、”=”或“<”)
完全沉淀,則反應后溶液的PH= 7(填“>”、”=”或“<”)
(3)將分別含有![]() 的四種溶液混合,調節溶液的PH值,使PH=1,充分反應后:
的四種溶液混合,調節溶液的PH值,使PH=1,充分反應后:
①若![]() 離子有剩余,上述四種離子在溶液中還存在的有 ,一定不存在的是
離子有剩余,上述四種離子在溶液中還存在的有 ,一定不存在的是
②若所得混合液呈紫色,上述四種離子在溶液中一定存在的有 ,
一定不存在的離子有 。
查看答案和解析>>
科目:高中化學 來源:2013屆山東省萊蕪市第一中學高三12月階段性測試化學試卷 題型:填空題
運用相關原理,回答下列各小題:
已知:NaHSO4在水中的電離方程式為 NaHSO4=Na+ + H+ + SO42-
(1)常溫下,pH=5的NaHSO4溶液中水的電離程度 pH=9的NH3·H2O中水的電離程度。(填 “>”、“=”或“<”)
(2)等體積等物質的量濃度的NaHSO4與氨水混合后,溶液呈酸性的原因為 。(用離子方程式表示);若一定量的NaHSO4溶液與氨水混合后,溶液pH=7,則[Na+]+[NH4+] 2[SO42-](填 “>”、“=”或“<”);用硫酸氫鈉與氫氧化鋇溶液制取硫酸鋇,若溶液中SO42-完全沉淀,則反應后溶液的pH 7。(填“>”、“=”或“<” )
(3)將分別含有MnO4-、Fe3+、Fe2+、I-的四種溶液混合,調節溶液的pH值,使pH=1,
充分反應后:
①若I-離子有剩余,上述四種離子在溶液中還存在的有 ,一定不存在的是 。
②若所得混合液呈紫色,上述四種離子在溶液中一定存在的有 ,
一定不存在的離子有 。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年山東省萊蕪市高三上學期期末檢測化學試卷 題型:填空題
(14分)運用相關原理,回答下列各小題:
已知: 在水中的電離方程式為
在水中的電離方程式為
(1)常溫下,PH=5的 溶液中水的電離程度 PH=9的
溶液中水的電離程度 PH=9的 中水的電離程度。(填“>”、”=”或“<”)
中水的電離程度。(填“>”、”=”或“<”)
(2)等體積等物質的量濃度的 與氨水混合后,溶液呈酸性的原因為 。(用離子方程式表示);若一定量的
與氨水混合后,溶液呈酸性的原因為 。(用離子方程式表示);若一定量的 溶液與氨水混合后,溶液PH=7,則
溶液與氨水混合后,溶液PH=7,則

 (填“>”、“=”或“<”不同);用硫酸氫鈉與氫氧化鈉溶液制取硫酸鋇,若溶液中
(填“>”、“=”或“<”不同);用硫酸氫鈉與氫氧化鈉溶液制取硫酸鋇,若溶液中 完全沉淀,則反應后溶液的PH= 7(填“>”、”=”或“<”)
完全沉淀,則反應后溶液的PH= 7(填“>”、”=”或“<”)
(3)將分別含有 的四種溶液混合,調節溶液的PH值,使PH=1,充分反應后:
的四種溶液混合,調節溶液的PH值,使PH=1,充分反應后:
①若 離子有剩余,上述四種離子在溶液中還存在的有 ,一定不存在的是
離子有剩余,上述四種離子在溶液中還存在的有 ,一定不存在的是
②若所得混合液呈紫色,上述四種離子在溶液中一定存在的有 ,
一定不存在的離子有 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com