
【題目】熱化學:(1)已知:C(s)+H2O(l)=CO(g)+H2(g) ΔH1=a kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) ΔH2=bkJ·moL-1;
2H2(g)+O2(g)=2H2O(l) ΔH3=ckJ·moL-1;
則C(s)+O2(g)=CO2(g) ΔH=___(用a、b、c表示)kJ·moL-1。
(2)根據鍵能數據估算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反應熱ΔH=___。
化學鍵 | C—H | C—F | H—F | F—F |
鍵能(kJ·mol-1) | 414 | 489 | 565 | 155 |
【答案】![]() (2a+b+c) -1940 kJ·mol-1
(2a+b+c) -1940 kJ·mol-1
【解析】
(1)根據蓋斯定律分析計算;
(2)ΔH=反應物斷裂化學鍵吸收的能量-生成物形成化學鍵放出的能量。
(1)C(s)+H2O(l)=CO(g)+H2(g) ΔH1=a kJ·mol-1 ①;
2CO(g)+O2(g)=2CO2(g) ΔH2=bkJ·moL-1 ②;
2H2(g)+O2(g)=2H2O(l) ΔH3=ckJ·moL-1 ③;
則根據蓋斯定律可知,![]() (①
(①![]() 2+②+③)得到C(s)+O2(g)=CO2(g),因此ΔH=
2+②+③)得到C(s)+O2(g)=CO2(g),因此ΔH=![]() (2ΔH1+ΔH2+ΔH3)=
(2ΔH1+ΔH2+ΔH3)=![]() (2a+b+c) kJ·moL-1,故答案為:
(2a+b+c) kJ·moL-1,故答案為:![]() (2a+b+c);
(2a+b+c);
(2)結合表格數據,根據反應CH4(g)+4F2(g)=CF4(g)+4HF(g)可知,ΔH=4![]() 414 kJ·mol-1+4
414 kJ·mol-1+4![]() 155 kJ·mol-1-4
155 kJ·mol-1-4![]() 489 kJ·mol-1-4
489 kJ·mol-1-4![]() 565 kJ·mol-1=-1940 kJ·mol-1,故答案為:-1940 kJ·mol-1。
565 kJ·mol-1=-1940 kJ·mol-1,故答案為:-1940 kJ·mol-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】下列各有機物無論二者以什么比例混合,只要總物質的量一定,則完全燃燒生成H2O的質量和消耗氧氣的質量不變的是( )
① 丙烷、丁炔 ② 丙烯、C4H6O2 ③ 乙炔、苯 ④ 甲醇、C3H4O5
A.①③B.①②C.②④D.③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制備硝基苯,反應裝置如圖。下列對該實驗的敘述錯誤的是
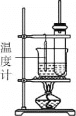
A.長玻璃管起冷凝回流作用
B.水浴加熱其優點是受熱均勻,便于控制溫度
C.粗產品依次用蒸餾水和5%NaOH溶液洗滌,最后再用蒸餾水洗滌
D.洗滌后,用無水CaCl2干燥,然后過濾,得到純硝基苯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為甲烷晶體的晶胞結構,下列有關說法正確的是( )
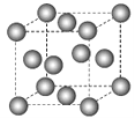
A.甲烷晶胞中的球體只代表一個碳原子
B.晶體中1個![]() 分子有12個緊鄰的甲烷分子
分子有12個緊鄰的甲烷分子
C.![]() 晶體熔化時需克服共價鍵
晶體熔化時需克服共價鍵
D.一個甲烷晶胞中含有8個![]() 分子
分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知電解NaOH溶液即電解水:2H2O![]() 2H2↑+O2↑。現對100g 11.7%的NaCl溶液進行電解,總共通過電子0.4mol。
2H2↑+O2↑。現對100g 11.7%的NaCl溶液進行電解,總共通過電子0.4mol。
(1)在陰極產生的氫氣的體積(按標準狀況計)為______
(2)陽極產生的氧氣的物質的量為__________
(3)假定控制條件使Cl2未從電解液中逸出,電解結束后經充分攪拌Cl2與NaOH發生了完全反應,生成NaClO和部分NaClO3。求完全反應后電解池中三種鈉鹽的總質量____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C、D、E五種元素,它們的核電荷數依次增大。已知:A失去一個電子后就成為一個質子;B有兩個電子層,其最外層的電子數是次外層電子數的2倍;C的L層得2個電子后成為穩定結構;D是海水中含量第一位的金屬元素;E的最外層電子比次外層電子少一個。請填寫下列空格:
(1)A形成的單質的結構式為______; BC2的電子式_______________。
(2)D離子的結構示意圖_________,D、E結合形成的化合物的電子式_____
(3)B、C、D三種元素可形成一種化合物,其化學式為_____,所含的化學鍵有____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,用0.1mol·L-1的NaOH溶液分別滴定相同濃度的弱酸HX、HY的稀溶液,其滴定曲線如圖所示。下列說法錯誤的是( )
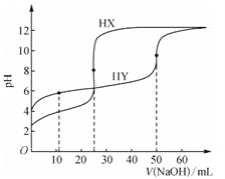
A.HX的酸性比HY的強B.滴定過程中,均可用酚酞作指示劑
C.室溫下,Ka(HY)的數量級約為10-4 D.滴定前,HY的體積為HX的兩倍
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁、鈦、鋇(第2主族)等元素在能源、材料等領域應用廣泛。回答下列問題:
⑴與鈦同周期的所有副族元素的基態原子中,最外層電子數與基態鈦原子相同的元素有________種。基態Ti2+的最外層電子排布式為________________。
⑵鋁的逐級電離能數據為:I1=580 kJmol-1、I2=1820 kJmol-1、I3=2750 kJmol-1、I4=11600 kJmol-1。請分析數據規律,預測鋇的逐級電離能的第一個數據“突躍”點出現在________之間(用I1、I2、I3等填空![]() 。
。
⑶已知第ⅡA族元素的碳酸鹽MCO3熱分解的主要過程是:M2+結合碳酸根離子中的氧離子。則CaCO3、BaCO3的分解溫度較高的是________________(填化學式),理由是________________。
⑷催化劑M能催化乙烯、丙烯、苯乙烯等的聚合,其結構如圖1所示。
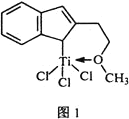
①M中,碳原子的雜化類型有________________。
②M中,不含________![]() 填標號
填標號![]() 。
。
A. π鍵 B. δ鍵 C. 配位鍵 D.氫鍵 E. 離子鍵
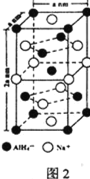
⑸氫化鋁鈉(NaAlH4)是一種新型輕質儲氫材料,其晶胞結構如圖2所示,為長方體。寫出與AlH4-空間構型相同的一種分子_______________(填化學式)。NaAlH4晶體中,與AlH4-緊鄰且等距的Na+有________個;NaAlH4晶體的密度為________ gcm-3(用含a、NA的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.火箭升空需要高能的燃料,經常是用N2O4和N2H4作為燃料,工業上利用N2和H2可以合成NH3,NH3又可以進一步制備聯氨(N2H4)等。已知:
N2(g) + 2O2(g)=2NO2(g) △H= +67.7kJ·mol-1
N2H4(g) + O2(g)=N2(g) + 2H2O(g) △H=-534.0kJ·mol-1
NO2(g)![]() 1/2N2O4(g) △H=-26.35kJ·mol-1
1/2N2O4(g) △H=-26.35kJ·mol-1
試寫出氣態聯氨在氣態四氧化二氮中燃燒生成氮氣和氣態水的熱化學方程式:___。
Ⅱ.1100℃時,體積為2L的恒容容器中發生如下反應:Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)下列能判斷反應達到平衡狀態的是____。
A.容器中壓強不變 B.混合氣體密度不變
C.1molH-H鍵斷裂同時形成2 mol H-O D.H2的體積分數不變
(2)若2min時反應達平衡,此時氣體質量增加8g,則用H2表示該反應的反應速率為___。
(3)某溫度下該反應達平衡狀態,測得混合氣體的平均相對分子質量為14,則該溫度下的平衡常數K為_____。
(4)若反應達平衡后,加入少量的H2,再次平衡后,H2O的體積分數___(填“增大”、“減小”或“不變”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com