
【題目】關于氨的下列敘述中,不正確的是( )
A.液氨是純凈物
B.實驗室制氨氣的方法是加熱NH4Cl
C.氨易液化,因此可用來作制冷劑
D.氨極易溶于水,因此可用來作噴泉實驗
 尖子生新課堂課時作業系列答案
尖子生新課堂課時作業系列答案 英才計劃同步課時高效訓練系列答案
英才計劃同步課時高效訓練系列答案科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
A.非金屬元素之間構成的化合物都不是離子化合物
B.陰、陽離子通過靜電引力所形成的化學鍵叫離子鍵
C.離子化合物中一定沒有共價鍵
D.含有陽離子的化合物一定含有陰離子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在有機化學反應中,通常把有機物分子中失去氫原子或加入氧原子的反應叫做氧化反應,反之叫做還原反應。工處生產苯乙烯是利用乙苯的脫氫反應:![]() (正反應吸熱)。針對上述反應,在其它條件不變時,下列說法正確的是
(正反應吸熱)。針對上述反應,在其它條件不變時,下列說法正確的是
A. 該反應屬于還原反應 B. 乙苯分子式C8H11
C. 苯乙烯最多16個原子共平面 D. 此逆反應不屬于加成反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙二醇(沸點:197.3℃)是一種重要的基礎化工原料。由煤基合成氣(主要成分CO、H2)與氧氣先制備得到草酸二甲酯(沸點:164.5℃),再加氫間接合成乙二醇,具有反應條件溫和、環境污染小等優點。反應過程如下:
反應I:4NO(g)+4CH3OH(g)+O2(g)![]() 4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1
反應II:2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
反應III:CH3OOCCOOCH3(1)+4H2(g)![]() HOCH2CH2OH(1)+2CH3OH(g)△H3 =c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g)△H3 =c kJ·mol-1
請回答下列問題:
(1)煤基合成氣間接合成乙二醇的總熱化學方程式是_____________________________,已知該反應在較低溫條件下能自發進行。說明該反應的△H ______0(填“>”“<”或“=”)。
(2)CO、CH3ONO各0.4mol在恒溫、容積恒定為2L的密閉容器中發生反應II,達到平衡時CO的體積分數與NO的體積分數相等,計算該反應的化學平衡常數K=_____________。若此時向容器中再通入0.4molNO,一段時間后,達到新平衡時NO的體積分數與原平衡時相比______(填“增大”“相等”“減小”或“不能確定”)。
(3)溫度改變對反應II的催化劑活性有影響,評價催化劑的活性參數——空時收率和CO的選擇性可表示如下:
空時收率=CH3OOCCOOCH3質量/反應時間×催化劑的體積
CO的選擇性=合成[CH3OOCCOOCH3所消耗的CO的物質的量/反應掉的CO的物質的量]×100%
在不同溫度下,某學習小組對四組其他條件都相同的反應物進行研究,經過相同時間th,測得空時收率、CO的選擇性數據如下表所示。
反應溫度(℃) | 空時收率(g·mL-1·h-1) | CO的選擇性(%) |
130 | 0.70 | ①72.5 |
140 | 0.75 | ②71.0 |
150 | 0.71 | ③55.6 |
160 | 0.66 | ④63.3 |
下列說法正確的是________(填字母代號)。
A.溫度升高,空時收率先增大后減小,說明△H2>0
B.溫度升高,催化劑活性逐漸減弱,對CO的選擇性逐漸降低
C.綜合考慮空時收率和CO的選擇性,工業生成CH3OOCCOOCH3時,選擇140℃效果最好
D.130℃時,CO的選擇性最高,說明CO生成CH3OOCCOOCH3的轉化率最高
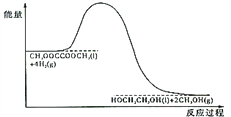
(4)120℃、常壓時,CH3OOCCOOCH3+4H2![]() HOCH2CH2OH+2CH3OH反應過程中的能量變化如圖所示。畫出180℃、常壓時,加入催化劑,該反應過程中的能量變化圖。________
HOCH2CH2OH+2CH3OH反應過程中的能量變化如圖所示。畫出180℃、常壓時,加入催化劑,該反應過程中的能量變化圖。________
(5)研究證實,乙二醇、氧氣可以在堿性溶液中形成燃料電池,負極的電極反應式是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是一種正投入生產的大型蓄電系統。放電前,被膜隔開的電解質為Na2S2和NaBr3,放電后分別變為Na2S4和NaBr。下列敘述正確的是

A. 放電時,負極反應為3NaBr-2e-==NaBr3+2Na+
B. 充電時,陽極反應為2Na2S2-2e-== Na2S4+2Na+
C. 放電時,Na+經過離子交換膜,由b池移向a池
D. 用該電池電解飽和食鹽水,產生2.24LH2時,b池生成17.40g Na2S4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】烴A在一定條件下可以轉化為有機物E,其轉化關系如下圖。已知烴A在標準狀況下的密度為116g/L,加熱時B與新制氫氧化銅產生磚紅色沉淀,E為有濃郁香味、不易溶于水的油狀液體。
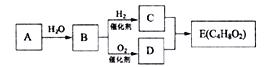
請回答:
(1)B中官能團的結構簡式為_________________________。
(2)C+D→E的化學方程式為___________________________________。
(3)下列說法正確的是______
a.C物質與金屬鈉反應比水與金屬鈉反應更劇烈
b.有機物C、D、E可用飽和Na2CO3溶液鑒別
c.實驗室制備E時,加入濃鹽酸做催化劑
d.B能被酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,回答下列有關問題:
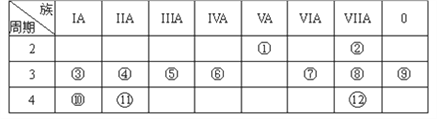
(1)寫出元素符號:⑨________(填化學式,下同)
(2)在這些元素中,最活潑的金屬元素是________,最活潑的非金屬元素是________。
(3)在這些元素的最高價氧化物對應水化物中,酸性最強的是________,呈兩性的氫氧化物是________。
(4)寫出③和⑧形成的化合物的電子式__________________。
(5)寫出④和⑧所構成的化合物的化學鍵類型__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“一帶一路”為中國化工企業開辟了新的國際市場,而能源、資源整合及環境治理是保駕護航的基礎。
Ⅰ.在能源領域,科學家提出“綠色自由“”構想: 把含有大量CO2的空氣吹入K2CO3溶液中,再把CO2從溶液中提取出來,并使之與H2反應生成可再生能源甲醇。其工藝流程如下圖所示:
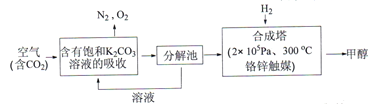
(1)在合成塔中,若有4400gCO2與足量H2完企反應,生成氣態的H2O和氣態甲醇,可放出5370kJ的熱量,寫出該反應的熱化學方程式__________。
(2)一定條件下,向2L恒容密閉容器中充入1molCO2和3molH2,在不同催化劑作用下發生反應Ⅰ、反應Ⅱ與反應Ⅲ,相同時間內CO2的轉化率隨溫度變化如下圖所示:
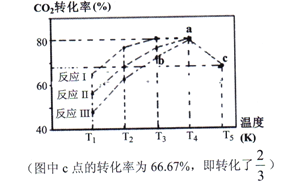
①催化劑效果最佳的反應是__________(填“反應I”,“反應II”,“反應III”)。
②b點v (正)______ v (逆)(填 “>”, “<”, “=”)。
③c點時該反應的平衡常數K =_________。(寫單位)
Ⅱ.環境治理中,安裝汽車尾氣催化轉化器的反應是:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)ΔH<0
2CO2(g)+N2(g)ΔH<0
(3)溫度升高K值_______(填“增大”或“減小”)
(4)若反應在恒容的密閉體系中進行,下列示意圖正確且能說明反應在進行到t1時刻達到平衡狀態的是____________。

(5)下列所示裝置可以在吸收SO2的同時,用陰極排出的溶液吸收NO2,(電極均為惰性電極)

a極為______極(填“陰”、“陽”),b極的電極反應式為_________,結合電極反應式簡述該裝置能吸收SO2的原理:__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com