
【題目】如圖兩瓶體積相等的氣體,在同溫同壓時瓶內氣體的關系一定正確的是( )

A. 所含原子數相等 B. 氣體密度相等C.氣體質量相等 D.摩爾質量相等
【答案】A
【解析】試題解析:同溫同壓下,氣體摩爾體積相等,相同體積的氣體,其物質的量相等, A.根據N=nNA知,二者物質的量相等,則其分子數相等,每種分子都含有兩個原子,所以其原子總數一定相等,故A正確; B、根據ρ=M/Vm;知,氣體摩爾體積相等時,其密度之比等于摩爾質量的反比,二者摩爾質量不一定相等,所以其密度不一定相等,B錯誤; C、根據m=nM知,物質的量相等時,氣體質量之比等于其摩爾質量之比,二者摩爾質量不一定相等,所以其質量不一定相等,C錯誤; D、NO的摩爾質量是個定值,是30g/mol,而混合氣體N2和O2的平均摩爾質量M=m/n;由于混合氣體的質量m總隨著N2和O2所占百分含量的不同而變化,平均摩爾質量M在一個范圍內變化,不是一個定值,故M不一定相同,故D錯誤.
考點: 考察阿伏伽德羅定律;


科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列敘述正確的是 ( )
A. 常溫下,0.1 mol·L一1的碳酸鈉溶液中含有的陰離子數大于0.1NA
B. 標準狀況下,33.6 mL氯氣通人足量水中發生反應,轉移電子數為1.5×10-3NA
C. 常溫常壓下,28 g由C3H6和C4H8組成的混合氣體中含共用電子對數目為6NA
D. 同溫下,pH=1體積為1 L的硫酸溶液所含氫離子數與pH=13體積為1 L的氫氧化鈉溶液所含氫氧根離子數均為0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,通過下列反應可以制備特種陶瓷的原料MgO: MgSO4(s)+CO(g) ![]() MgO(s)+CO2(g)+SO2(g) △H >0,該反應在某密閉容器中達到平衡。下列分析正確的是
MgO(s)+CO2(g)+SO2(g) △H >0,該反應在某密閉容器中達到平衡。下列分析正確的是
A. 恒溫恒容時,充入CO氣體,達到新平衡時![]() 增大
增大
B. 容積不變時,升高溫度,混合氣體的平均相對分子質量減小
C. 恒溫恒容時,分離出部分SO2氣體可提高MgSO4的轉化率
D. 恒溫時,增大壓強平衡逆向移動,平衡常數減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為驗證氧化性Cl2>Fe3+> SO2,某小組用下圖所示裝置進行實驗(夾持儀器和A中加熱裝置已略,氣密性已檢驗)。
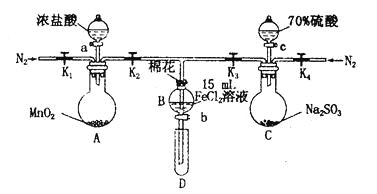
實驗過程:
I.打開彈簧夾K1~K4,通入一段時間N2,再將T型導管插入B中,繼續通入N2,然后關閉K1、K3、K4。
Ⅱ.打開活塞a,滴加一定量的濃鹽酸,給A加熱。
Ⅲ.當B中溶液變黃時,停止加熱,關閉K2。
Ⅳ.打開活塞b,使約2 mL的溶液流入D試管中,檢驗其中的離子。
V.打開K3和活塞c,加入70%的硫酸,一段時間后關閉K3。
Ⅵ.更新試管D,重復過程Ⅳ,檢驗B溶液中的離子。
(1)過程I的目的是____。
(2)檢驗B中溶液是否還有Fe2+的方法之一是:取少量B中溶液于試管中,滴加幾滴含有+3價鐵元素的配合物溶液,會產生藍色沉淀.寫出該反應的離子方程式____ 。
(3)若向第III步B中的黃色溶液中通入H2S氣體,會觀察到有淡黃色沉淀生成,寫出該反應的離子方程式____。
(4)若將制取的SO2通入硫酸酸化的高錳酸鉀溶液可使溶液褪色,其反應的化學方程式為________。
(5)甲、乙、丙三位同學分別完成了上述實驗,結論如下表所示。他們的檢測結果一定不能夠證明氧化性Cl2>Fe3+>SO2的是____(填“甲”、“乙”或“丙”)。
過程Ⅳ,B溶液中含有的離子 | 過程Ⅵ,B溶液中 含有的離子 | |
甲 | 有Fe3+無Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+無Fe2+ | 有Fe2+ |
(6)將B中的FeCl2溶液換成100 mLFeBr2溶液并向其中通入1.12 LCl2(標準狀況下),若溶液中有1/2的Br一被氧化成單質Br2,則原FeBr2溶液中FeBr2的物質的量濃度為____ mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有下列儀器:

(1)海水蒸餾是由海水獲得淡水的常用方法之一,在實驗室里組成一套蒸餾裝置肯定 需要上述儀器中的一部分,按照實驗儀器從下到上、從左到右的順序,依次是__________ (填序號);儀器⑤的冷凝水應從________(填“a”或“b”)口進入。
(2)海帶等藻類物質經過處理后,可以得到碘水,欲從碘水中提取碘,需要上述儀器 中的______(填序號),該儀器名稱為__________,向該碘水中加入四氯化碳以提取碘 單質的實驗操作叫做_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】植物油廠想要提取大豆中豐富的油脂,下列方案設計合理的是( )
A.將大豆用水浸泡,使其中的油脂溶于水,然后再分餾
B.先將大豆壓成顆粒狀,再用無毒的有機溶劑浸泡,然后對浸出液進行蒸餾分離
C.將大豆用堿溶液處理,使其中的油脂溶解,然后再蒸發出來
D.將大豆粉碎,然后隔絕空氣加熱,使其中的油脂揮發出來
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(NH4)2Fe(SO4)2·6H2O俗稱莫爾鹽,淺綠色晶體,是化學定量分析中的常用試劑。其分解情況復雜,某課題組通過實驗檢驗莫爾鹽隔絕空氣加熱時的分解產物。
⑴分解裝置A應選用_________(填“①”或“②”)。


① ②
⑵若實驗中A裝置中的固體變為紅棕色,則固體產物中含有_____;C裝置中紅色褪去,說明氣體產物中含有______;C裝置后應連裝置D(未畫出),其作用是_______。
⑶若想利用上述裝置證明分解產物中含有氨氣,只需更換B、C中的試劑即可,則更換后的試劑為B_____________、C______________(填序號)。
①堿石灰 ②無水氯化鈣 ③酚酞溶液 ④稀硫酸
⑷某同學認為莫爾鹽分解還可能會生成N2、SO3,擬從下列裝置中選擇合適的裝置加以證明,則正確的連接順序是A、_____、_____、E,反應一段時間后,再接_______。

⑸若實驗證實(2)(3)的猜想是正確的,(4)中的氣體產物只有一種,另外只有水生成,則據此推測的莫爾鹽分解反應的化學方程式可能為 ____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現需要0.1 mol·L1CuSO4溶液240 mL,實驗室提供以下試劑用于溶液的配制:蒸餾水、膽礬晶體(CuSO4·5H2O)、4 mol·L1CuSO4溶液
(1)無論采用何種試劑進行配制,除燒杯、玻璃棒、膠頭滴管外,至少還必須用到的一種玻璃儀器是_________,在使用該儀器前必須進行的操作是___________。
(2)若用膽礬晶體進行配制,需用托盤天平稱取CuSO4·5H2O的質量為_______ g;如果用 4 mol/L的CuSO4溶液稀釋配制,需用量筒量取________mL 4 mol/LCuSO4溶液。
(3)用4 mol/L的硫酸銅溶液稀釋配制溶液所需的實驗步驟有:
a.用量筒量取一定體積4 mol/L的硫酸銅溶液于一燒杯中
b.洗滌燒杯和玻璃棒2~3次并將洗滌液注入容量瓶,輕輕搖動容量瓶,使溶液混合均勻
c.計算所需4 mol/L硫酸銅溶液的體積
d.蓋好瓶塞,反復上下顛倒搖勻后,將溶液轉存于試劑瓶中
e.加水至液面離容量瓶刻度線1~2 cm處改用膠頭滴管進行定容
f.往燒杯中加入約100 mL水進行初步稀釋,冷卻至室溫
g.將溶液轉移入容量瓶
其中正確的操作順序為______________________。
(4)下列操作對所配制溶液濃度的影響(填“偏高”“偏低”或“無影響”)。
①稱取的膽礬晶體失去了部分結晶水___________。
②定容時,仰視刻度線:___________。
③容量瓶未干燥,有少量蒸餾水:___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com