
| 酸 | 電離常數(Ka) | 酸 | 電離常數(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| H2CO3 | Ka1=4.2×10-7 | HClO | 3×10-8 |
| Ka2=5.6×10-11 |
分析 (1)0.1mol/LH2A溶液中c(H+)=0.11mol/L,則H2A的第一步為完全電離;
(2)0.1mol/LNaHA溶液中HA-的電離程度大于水解程度,溶液顯酸性;H2A溶液中第一步電離出來的氫離子抑制了第二步電離,則NaHA中HA-的電離程度大于H2A中HA-的電離程度;
(3)H2A溶液中主要存在H+和HA-;
(4)①電離常數越大,電解質的酸性越強;
②強堿弱酸鹽水解顯堿性;
③弱酸的酸性越弱,其酸根越易結合氫離子.
解答 解:(1)0.1mol/LH2A溶液中c(H+)=0.11mol/L,則H2A的第一步為完全電離,則H2A的第一步電離方程式:H2A=H++HA-;
故答案為:H2A=H++HA-;
(2)0.1mol/LNaHA溶液中HA-的電離程度大于水解程度,溶液顯酸性,則溶液中離子濃度大小關系為:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);
0.1mol/LH2A溶液中c(H+)=0.11mol/L,NaHA中HA-的電離程度大于H2A中HA-的電離程度,所以NaHA中c(H+)>0.01mol/L;
故答案為:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);>;
(3)H2A溶液中主要存在H+和HA-,則H2A溶液與過量NaOH溶液反應的離子方程式:H++HA-+2OH-=A2-+2H2O;
故答案為:H++HA-+2OH-=A2-+2H2O;
(4)①電離常數越大,電解質的酸性越強,由表中數據可知,醋酸的酸性最強;故答案為:CH3COOH;
②強堿弱酸鹽水解顯堿性,NaCN屬于強堿弱酸鹽,所以25℃時0.01mol/LNaCN溶液的pH>7;故答案為:>;
③弱酸的酸性越弱,其酸根越易結合氫離子,又根據弱酸的電離平衡常數可知弱酸的酸性大小順序為HCO3-<HClO<H2CO3<CH3COOH,所以體系中酸根離子反應的先后順序為CO32-、ClO-、HCO3-、CH3COO-,
故答案為:CO32-、ClO-、HCO3-、CH3COO-.
點評 本題主要考查了弱電解質的電離、離子濃度大小比較、鹽的水解原理的應用、電離常數的應用等,題目難度中等,注意根據電離平衡常數來判斷酸性強弱,注意弱酸的酸性越弱,其酸根越易水解.


 名牌學校分層周周測系列答案
名牌學校分層周周測系列答案 黃岡海淀全程培優測試卷系列答案
黃岡海淀全程培優測試卷系列答案科目:高中化學 來源: 題型:選擇題
| 電化學應用 | 相關解釋或說法 | |
| A | 以稀H2SO4為電解質的Cu-Zn原電池 | Cu為正極,正極上發生還原反應 |
| B | 電解CuCl2溶液 | 電子經過負極→陰極$\stackrel{通過電解液}{→}$陽極→正極 |
| C | 弱酸性環境下鋼鐵腐蝕 | 負極產生H2,正極處吸收O2 |
| D | 將銅閘門與外加電源負極相連 | 犧牲陽極的陰極保護法,可防止鋼閘門腐蝕 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等壓時,通入稀有氣體He,反應容器中溫度升高 | |
| B. | 等壓時,通入Z氣體,P氣體的物質的量不變 | |
| C. | 等容時,通入稀有氣體He,兩個反應速率均不變 | |
| D. | 等容時,通入Z氣體,Y的物質的量濃度增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
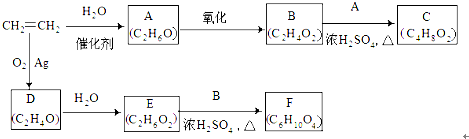
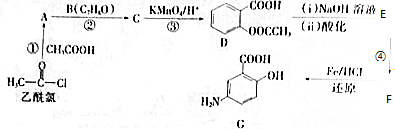
 E
E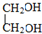 F
F 寫出C酸性條件下水解的方程式CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH
寫出C酸性條件下水解的方程式CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH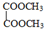 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 洗滌了量取濃硫酸的量筒,并把洗滌液轉移到容量瓶中 | |
| B. | 轉移溶液前,容量瓶中含有少量蒸餾水 | |
| C. | 溶解硫酸用的燒杯、玻璃棒未洗滌 | |
| D. | 定容時俯視容量瓶的刻度線 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3Cl+Cl2$\stackrel{光}{→}$CH2Cl2+HCl 取代反應 | |
| B. | H2C=CH2+Br2→CH3CHBr2 加聚反應 | |
| C. | 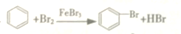 加成反應 加成反應 | |
| D. | 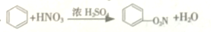 氧化反應 氧化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
. .
. (寫出其中一種結構簡式)
(寫出其中一種結構簡式)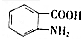 的流程圖(無機試劑任選).合成路線流程圖如下:
的流程圖(無機試劑任選).合成路線流程圖如下:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com