
【題目】根據題意解答
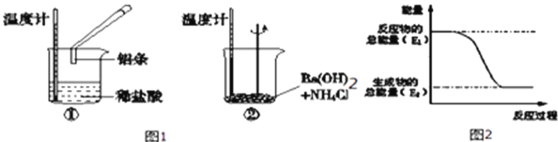
(1)某實驗小組同學進行如下實驗,以檢驗化學反應中的能量變化,據實驗現象判斷①是_________熱反應,②是_________熱反應.反應過程___(填“①”或“②”)的能量變化可用圖2表示.
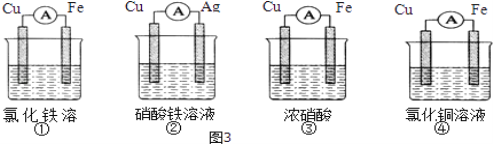
(2)為了驗證Fe3+與Cu2+氧化性強弱,下列裝置能達到實驗目的是_________(填序號).
(3)將H2設計成燃料電池,其利用率更高,裝置如圖4所示(a、b為多孔碳棒),負極通入_______其電極反應式為________________電池總反應為______________
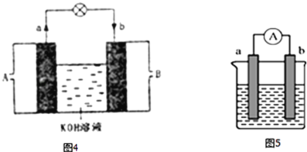

(4)如圖5是某化學興趣小組探究不同條件下化學能轉變為電能的裝置.
①若兩個電極分別是鋅、銅,電解質溶液是稀硫酸,正極的電極反應式___________;若電極保持不變,將電解質溶液換成硫酸銅,請將該電池設計為雙液原電池畫入圖6中___________;
②當電極a為Al、電極b為Mg、電解質溶液為氫氧化鈉時,該原電池的負極為_______;該原電池的電池總反應為_____________________________.
③若電池的總反應是2FeCl3+Fe![]() 3FeCl2,則可以作正極材料的是________,正極反應式是__________若該電池反應消耗了0.1mol FeCl3,則轉移電子的數目為_____。
3FeCl2,則可以作正極材料的是________,正極反應式是__________若該電池反應消耗了0.1mol FeCl3,則轉移電子的數目為_____。
【答案】放 吸 ① ② H2 H2-2e-+2OH-=2H2O 2H2+O2=2H2O 2H++2e-=H2  Al 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 比鐵不活潑的金屬或石墨 Fe3++e-=Fe2+ 0.1NA
Al 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 比鐵不活潑的金屬或石墨 Fe3++e-=Fe2+ 0.1NA
【解析】
當反應物總能量大于生成物總能量時,反應為放熱反應;驗證Fe3+與Cu2+氧化性強弱,可以通過氧化還原反應進行驗證;氫氧燃料電池中氫氣在負極發生反應,氧氣在正極發生反應;原電池中負極發生氧化反應,正極發生還原反應,據此判斷正負極材料。
(1)Al與HCl反應后,溫度升高,則說明反應放熱,Ba(OH)28H2O與NH4Cl的反應溫度降低,說明反應為吸熱反應;反應①為放熱反應,反應物的總能量大于生成物的總能量,所以①的能量變化可用圖2表示。
(2)為了驗證Fe3+與Cu2+氧化性強弱,可通過氧化還原反應Cu+2Fe3+= 2Fe2++ Cu2+來驗證,將該反應設計成原電池,銅作負極,比銅不活潑的金屬或石墨作正極,選擇含Fe3+的電解質溶液,若電流計指針偏轉說明反應能發生,證明Fe3+氧化性強于Cu2+,則裝置②符合要求。
(3)氫氧燃料電池中氫氣在負極發生反應,電極反應式為H2-2e-+2OH-=2H2O,電池的總反應式為2H2+O2=2H2O。
(4)①若兩個電極分別是鋅、銅,電解質溶液是稀硫酸,則鋅作負極,銅作正極,正極的電極反應式為2H++2e-=H2;若電極保持不變,將電解質溶液換成硫酸銅,將鋅棒插入到硫酸鋅溶液中,銅棒插入到硫酸銅溶液中,中間用鹽橋連接形成雙液原電池,裝置如圖:
 。
。
②當電極a為Al、電極b為Mg、電解質溶液為氫氧化鈉時,Al能與氫氧化鈉發生氧化還原反應,則Al作原電池的負極;該原電池的電池總反應為2Al+2NaOH+2H2O=2NaAlO2+
3H2↑。
③根據電池的總反應2FeCl3+Fe![]() 3FeCl2可知,鐵作負極,則正極材料應為比鐵不活潑的金屬或石墨,Fe3+在正極得電子發生還原反應,電極反應式是Fe3++e-=Fe2+;根據電極反應式可知,若該電池反應消耗了0.1mol FeCl3,則轉移電子的數目為0.1NA。
3FeCl2可知,鐵作負極,則正極材料應為比鐵不活潑的金屬或石墨,Fe3+在正極得電子發生還原反應,電極反應式是Fe3++e-=Fe2+;根據電極反應式可知,若該電池反應消耗了0.1mol FeCl3,則轉移電子的數目為0.1NA。


科目:高中化學 來源: 題型:
【題目】某固體可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-,中的幾種離子,取等質量的兩份該固體,進行如下實驗(不考慮鹽類的水解及水的電離);
⑴一份固體溶于水得無色透明溶液,加入足量BaCl2溶液,得沉淀4.66g,在沉淀中加入過量稀鹽酸,沉淀沒變化.
⑵另一份固體與過量NaOH固體混合后充分加熱,產生使濕潤的紅色石蕊試紙變藍色的氣體0.672L(標準狀況).
下列說法正確的是( )
A.該固體中一定含有NH4+、SO42-、Na+B.該固體中一定沒有Cu2+、Cl-
C.該固體中只含有NH4+、CO32-、SO42-、Cl-D.根據以上實驗,無法確定該固體中有Na+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗探究:探究碳、硅元素的非金屬性的相對強弱。根據要求完成 下列各小題。
(1)實驗裝置:

填寫所示儀器名稱 A_________B________________________
(2)實驗步驟:
連接儀器、_____________、加藥品后,打開 a、然后滴入濃硫酸,加熱
(3)問題探究:(已知酸性強弱:亞硫酸 >碳酸)
①銅與濃硫酸反應的化學方程式是________________________________;裝置E中足量酸性KMnO4溶液的作用是_____________________________;
②能說明碳元素的非金屬性比硅元素非金屬性強的實驗現象是____________________________;
③依據試管 D 中的實驗現象,能否證明硫元素的非金屬性強于碳元素的非金屬性___(填 “能”或“否”),試管 D 中發生反應的離子方程式是______________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某烴結構如下:![]() ,有關其結構說法正確的是( )
,有關其結構說法正確的是( )
A. 所有原子可能在同一平面上B. 最多有5個原子在同一條直線上
C. 所有碳原子可能在同一平面上D. 所有氫原子可能在同一平面上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物,只可能含有C、H、O三種元素,在標況下,其蒸氣的密度是H2的21倍。測得其質量為10.5g,在氧氣中充分燃燒,生成33g二氧化碳和13.5g水,求該化合物的分子式,并寫出其所有可能結構簡式。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋約占地球表面積的71%,具有巨大的開發潛力。
Ⅰ.海水淡化的方法主要有蒸餾法、電滲析法和離子交換法等。下圖所示為海水蒸餾原理示意圖,請回答下列問題:
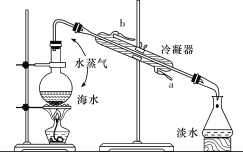
(1)冷卻水的出水口是________(填“a”或“b”);
(2)碎瓷片的作用是__________。
Ⅱ.目前,從海水提取的溴占世界溴年產量的三分之一左右,空氣吹出法是工業大規模海水提溴的常用方法。其中一種工藝流程為:
①海水濃縮,酸化;
②通入Cl2,使Br-轉化為Br2;
③通入空氣、水蒸氣,將Br2吹入吸收塔,與吸收劑SO2反應轉化為HBr;
④通入Cl2,再經過一系列處理得到產品Br2。
請回答下列問題:
(1)步驟②③的目的是_____________(填“富集溴”或“萃取溴”);
(2)在步驟③中,反應生成HBr的化學方程式___________________________________________;
(3)在步驟②中,若通入44.8 L Cl2(標準狀況),理論上可得到Br2___________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫時,改變飽和氯水的pH,得到部分含氯微粒的物質的量分數與pH的關系如圖所示。下列敘述不正確的是
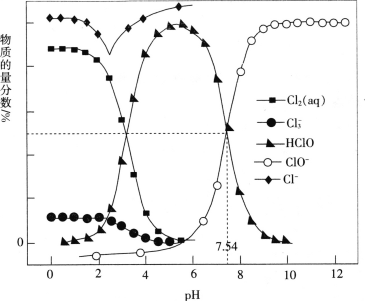
A.pH=1的氯水中,c(Cl2)>c(Cl3-)>c(HClO)>c(ClO-)
B.氯水中的Cl2、ClO-、HClO均能與K2S發生反應
C.已知常溫下反應Cl2(aq)+Cl-(aq)![]() Cl3- (aq)的K=0.191,當pH增大時,K減小
Cl3- (aq)的K=0.191,當pH增大時,K減小
D.該溫度下,HClO![]() H++ClO-的電離常數Ka=10-7.54
H++ClO-的電離常數Ka=10-7.54
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素X、Y、Z、W、Q在元素周期表中的相對位置如圖1所示。下列說法正確的是
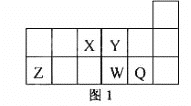
A. 元素X與元素Z的最高正化合價之和的數值等于8
B. 原子半徑的大小順序為:rX>rY>:rZ>rW>rQ
C. 離子Y2-和Z 3+的核外電子數和電子層數都不相同
D. 元素W的最高價氧化物對應的水化物的酸性比Q的強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素鉻(Cr)的幾種化合物存在下列轉化關系,下列判斷不正確的是
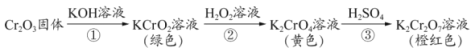
A.反應①表明Cr2O3有酸性氧化物的性質
B.反應②利用了H2O2的氧化性
C.反應②的離子方程式為2CrO2ˉ+3H2O2+2OHˉ=2CrO42ˉ+4H2O
D.反應①②③中鉻元素的化合價均發生了變化
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com