
【題目】合金是重要的金屬材料.
(1)下列物品所使用的主要材料屬于合金的是(填字母序號,下同).
A.青花瓷瓶
B.橡膠充氣艇
C.不銹鋼鍋
(2)生鐵是常用的合金,生鐵屬于(填“純凈物”或“混合物”).
(3)黃銅是銅鋅合金,將純銅片和黃銅片互相刻畫(如圖所示),純銅片上留下明顯的劃痕,說明 .
(4)黃銅渣中約含Zn7%、ZnO31%、Cu50%、CuO5%,其余為雜質.處理黃銅渣可得到硫酸鋅,其主要流程如下(雜質不溶于水、不參與反應): 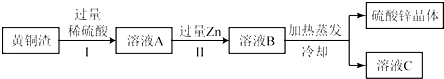
已知:ZnO+H2SO4═ZnSO4+H2O; CuO+H2SO4═CuSO4+H2O
①Ⅱ中反應的化學方程式為;
②下列說法正確的是 .
a.Ⅰ、Ⅱ中的操作均包含過濾 b.溶液A中ZnSO4的質量大于CuSO4
c.溶液A 的質量小于溶液B d.溶液C中溶質的質量分數小于溶液B.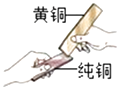
【答案】
(1)C
(2)混合物
(3)黃銅硬度比純銅大
(4)Zn+CuSO4=ZnSO4+Cu;abc
【解析】解:(1)青花瓷瓶屬于硅酸鹽材料;橡膠充氣艇屬于有機高分子材料;不銹鋼鍋屬于合金,所以答案是:C;(2)生鐵是常用的合金,合金屬于混合物,故生鐵屬于混合物,所以答案是:混合物;(3)將純銅片和黃銅片互相刻畫,純銅片上留下明顯的劃痕,說明黃銅的硬度比純銅的硬度大,所以答案是:黃銅的硬度比純銅的硬度大;(4)①由于鋅排在氫和銅的前面,故鋅既可以與酸反應,也可以與硫酸銅反應,反應的化學方程式分別為:Zn+H2SO4═ZnSO4+H2↑,Zn+CuSO4=ZnSO4+Cu, 所以答案是:Zn+H2SO4═ZnSO4+H2↑,Zn+CuSO4=ZnSO4+Cu;
②由圖可知,操作Ⅰ過濾除去銅和雜質,操作Ⅱ過濾是除去鋅和置換出的銅;
因氧化鋅的質量大于氧化銅,另外鋅也能和硫酸反應生成硫酸鋅,而銅和硫酸不反應,故溶液A中硫酸鋅的質量大于硫酸銅;
溶液A加入鋅后,反應的化學方程式分別為:Zn+H2SO4═ZnSO4+H2↑,Zn+CuSO4=ZnSO4+Cu;對反應Zn+H2SO4═ZnSO4+H2↑分析可知,每65份質量的鋅進入溶液,從溶液中出來2份質量的氫氣,使得溶液質量增加,對于反應Zn+CuSO4=ZnSO4+Cu來說,每65份質量的鋅進入溶液,從溶液中析出64份質量的銅,也使得溶液質量增大;故溶液A的質量小于溶液B;溶液C為飽和溶液,質量分數達到同溫度下的最大值,故d錯誤,
所以答案是:abc.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】常溫常壓下,氣體體積的大小主要取決于
A. 構成氣體的分子的大小
B. 構成氣體的分子的相對分子質量大小
C. 構成氣體的分子數目的多少
D. 構成氣體的分子所含原子的多少
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在強堿溶液中,可能大量存在的離子組是( )
A.Na+、K+、AlO2﹣、Cl﹣B.Ba2+、Na+、Al3+、SO42﹣
C.K+、Mg2+、Cl﹣、NO3﹣D.Na+、Ca2+、Cl﹣、HCO3﹣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是不同溫度下水的離子積常數:
溫度/℃ | 25°C | 99°C |
水的離子積常數 | 1×l0-14 | 1×l0-12 |
試回答以下問題(設混合后溶液的體積為原兩溶液體積之和):
(1)25℃時,將pH=11的苛性鈉溶液V1L與pH=1的稀硫酸V2L混合,所得混合溶液的pH=2,則V1:V2 =___________。此溶液中各種離子的濃度由大到小的順序是_________________。
(2)99℃時,將pH=2的硫酸和pH=10的氫氧化鈉溶液等體積混合,則混合溶液中的c(H+)=__mol·L-1。
(3)假設H2A是強酸,但常溫下0.1mol·L-1H2A的溶液中c (H+)=0.11mol L-1,則NaHA溶液呈___________性(填“酸”、“堿”或“中”),0. lmol·L-1的NaHA溶液的c(H+)________0. 0lmol L-1 (填“>”、“<”或“=”);H2A溶液與Na2A溶液反應的離子方程式為_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A是一種常見的單質,B、C為中學常見的化合物,A、B、C均含有元素X,它們有如圖所示的轉化關系(部分產物及反應條件已略去)。下列推斷正確的是( )
![]()
A. X元素為鋁
B. 反應①和②互為可逆反應
C. X元素可能是金屬,也可能是非金屬
D. 反應①和②一定為氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組利用如圖裝置探究銅與濃硫酸反應的產物。
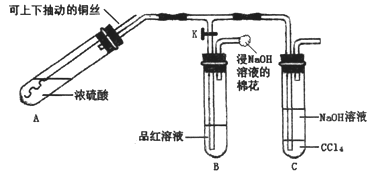
實驗步驟與現象如下:
①檢查裝置氣密性,向A中加入5 mL濃硫酸,打開K,將銅絲伸入濃硫酸中,給A處加熱,觀察到B中品紅溶液褪色,再關閉K。
②實驗觀察到A中液面下銅絲變黑,產生氣泡,液面上方產生大量白霧,一段時間后溶液中有白色固體出現,拉出銅絲,停止加熱。
將回答下列問題:
(1)C中CCl4的作用是_______________。
(2)下列說法中不合理的是:
A、上下移動A中銅絲可控制SO2的量
B、B中選用品紅溶液驗證有SO2生成
C、C中選用氫氧化鈉溶液吸收多余的SO2,也可以改為澄清石灰水
D、為確認A中白色固體是CuSO4,可向A中加入水,觀察顏色變化。
(3)取出銅絲,用蒸餾水洗凈后伸入到稀硫酸中,銅絲變亮、溶液變藍。寫出A中可能發生反應的化學方程式:_______________________、______________________。
(4)分離出C中的上層液體,滴加過量稀鹽酸和BaCl2溶液,有白色沉淀產生。
①分離的操作名稱為___________________:
②白色沉淀為:_______________________;
③產生白色沉淀的原因可能是______________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com