
【題目】(1)等質量的O2和O3所含分子個數比為___,原子個數比為___。
(2)400mL2.0mol/L的Al2(SO4)3溶液中含Al3+的物質的量為___,從中取出10mL,將這10mL溶液用水稀釋到100mL,所得溶液中SO42-的物質的量濃度為___。
(3)0.5 molCH4的質量為___;標準狀況下,4.48LNH3所含分子數為___。
(4)等物質的量的CH4和N2,所含原子數之比為___,等質量的CH4和N2物質的量之比為___。
(5)3.5molBa(OH)2中含有___個OH-,2.5molNaOH的摩爾質量為__。
【答案】3∶2 1∶1 1.6mol 0.6mol/L 8g 0.2NA 5∶2 7∶4 7NA 40g/mol
【解析】
(1)根據n=![]() 、N= n×NA及分子構成計算;
、N= n×NA及分子構成計算;
(2)根據n=cV進行計算,稀釋前后溶質的物質的量保持不變;
(3)依據n=![]() 計算,根據n=
計算,根據n=![]() 計算;
計算;
(4)1個CH4含有5個原子,1個N2含有2個原子,等物質的量的CH4和N2,分子個數相等;依據n=![]() 可知,質量相等時,n與M成反比計算;
可知,質量相等時,n與M成反比計算;
(5)根據n(OH-)=2n[Ba(OH)2]計算;摩爾質量是單位物質的量的物質的質量,以“g/mol”為單位時,數值上與相對分子質量相等。
(1)設O2和O3的質量都為m,根據n=![]() ,O2和O3的物質的量之比為
,O2和O3的物質的量之比為![]() ∶
∶![]() =3∶2,根據N=n×NA,則所含分子個數之比為3∶2,一個氧氣分子中含有2個氧原子,一個臭氧分子中含有3個氧原子,所以其原子個數比為(3×2)∶(2×3)=1∶1,故答案為:3∶2;1∶1;
=3∶2,根據N=n×NA,則所含分子個數之比為3∶2,一個氧氣分子中含有2個氧原子,一個臭氧分子中含有3個氧原子,所以其原子個數比為(3×2)∶(2×3)=1∶1,故答案為:3∶2;1∶1;
(2)n[Al2(SO4)3]=c×V=0.4L×2.0mol/L=0.8mol,含Al3+的物質的量為0.8mol×2=1.6mol;400mL2.0mol/L的Al2(SO4)3溶液中SO42-的物質的量濃度為2.0mol/L×3=6.0mol/L,稀釋前后,硫酸根離子的物質的量不變,則c1V1=c2V2,c2=![]() =0.6mol/L,故答案為:1.6mol,0.6mol/L;
=0.6mol/L,故答案為:1.6mol,0.6mol/L;
(3)m(CH4)=nM=0.5 mol×16g/mol=8g,標準狀況下,4.48LNH3的物質的量為![]() =0.2mol,含有的分子數為0.2mol×NAmol-1=0.2NA,故答案為:8g;0.2NA;
=0.2mol,含有的分子數為0.2mol×NAmol-1=0.2NA,故答案為:8g;0.2NA;
(4)1個CH4含有5個原子,1個N2含有2個原子,等物質的量的CH4和N2,分子個數相等,所含原子數之比為5∶2;依據n=![]() 可知,質量相等時,n與M成反比,所以等質量的CH4和N2物質的量之比為28g/mol∶16g/mol=7∶4,故答案為:5∶2;7∶4;
可知,質量相等時,n與M成反比,所以等質量的CH4和N2物質的量之比為28g/mol∶16g/mol=7∶4,故答案為:5∶2;7∶4;
(5)n(OH-)=2n[Ba(OH)2]=3.5mol×2=7mol,故OH-離子數目為7mol×NAmol-1=7NA;摩爾質量是單位物質的量的物質的質量,以“g/mol”為單位時,數值上與相對分子質量相等,因此NaOH的摩爾質量為40g/mol,故答案為:7NA;40g/mol。


 一本好題口算題卡系列答案
一本好題口算題卡系列答案科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
A.物質的量是研究物質所含微粒集體的多少,單位為mol
B.物質的量把微觀粒子數目與宏觀物質的質量聯系起來
C.1molNaCl晶體中含有NA個NaCl分子
D.12gC-12中所含的原子數為阿伏加德羅常數,NA近似為6.02×1023mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時有甲、乙、丙三種溶液,甲為0.1mol·L-1NaOH溶液,乙為0.1mol·L-1HCl溶液,丙為0.1 mol·L-1CH3COOH溶液,請回答下列問題:
(1)甲溶液的pH=___________________。
(2)乙溶液中由水電離出的c(H+)=___________________mol·L-1。
(3)寫出丙的電離方程式_________________________________________________________,其電離平衡常數表達式Ka=___________________。
(4)向丙中加入乙,會_____________(“抑制”或“促進”)丙的電離,c(H+)_____________(填“增大”、“減小”或“不變”), 丙的電離平衡常數Ka_____________(填“增大”、“減小”或“不變”)。
(5)各取25 mL的乙、丙兩溶液,分別用甲中和至pH=7,則消耗甲的體積大小關系為V(乙) ____________V (丙)(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某市售鹽酸試劑瓶標簽上的部分信息如下:
鹽酸
分子式:HCl
相對分子質量:36.5
密度約1.18gmL-1
HCl的質量分數:36.5%
(1)該鹽酸的物質的量濃度為_________ mol·L-1。
(2)取該鹽酸50 mL加水稀釋到500 mL,則稀釋后溶液中c(HCl)=_____mol·L-1。
(3)取稀釋后的適量鹽酸與足量的鋅粒作用,生成0.25 mol氫氣,在標準狀況下氣體的體積____ L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組數據中,前者剛好是后者兩倍的是 ( )
A. 2 mol H2O的摩爾質量和1 mol H2O的摩爾質量
B. 200 mL 1 mol·L-1氯化鈣溶液中c(Cl-)和100 mL 2 mol·L-1氯化鉀溶液中c(Cl-)
C. 64 g二氧化硫中氧原子數和標準狀況下22.4 L一氧化碳中氧原子數
D. 20% NaOH溶液中NaOH的物質的量濃度和10% NaOH溶液中NaOH的物質的量濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA代表阿伏加德羅常數,以下說法正確的是
A. 標準狀況下,11.2LH2O含H2O分子0.5NA
B. 1molFe與1molCl2充分反應轉移電子3NA
C. 常溫常壓下,32g O2與O3的混合氣中含氧原子2NA
D. 將0.1molFeCl3滴入沸水所形成膠體中含有氫氧化鐵膠體粒子數目為 0.1 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水是地球上最常見的物質之一,是所有生命生存的重要資源。
(1)![]() 鍵和
鍵和![]() 鍵是共價鍵的兩種基本類型,則H2O分子中含有的共價鍵數目和類型為________;水溶液中存在H3O+離子,寫出該微粒的結構式________(標出配位鍵)。
鍵是共價鍵的兩種基本類型,則H2O分子中含有的共價鍵數目和類型為________;水溶液中存在H3O+離子,寫出該微粒的結構式________(標出配位鍵)。
(2)科學家發現在特殊條件下,水能表現出許多種有趣的結構和性質
①一定條件下給水施加一個弱電場,常溫常壓下水結成冰,俗稱“熱冰”,其計算機模擬圖如下:
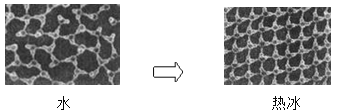
使水結成“熱冰”采用“弱電場”的條件,說明水分子是______分子。下列物質熔化時,所克服的微粒間的作用與“熱冰”熔化時所克服的作用力類型完全相同的是______。
A.固態氨 B.食鹽 C.干冰 D.金剛石
②用高能射線照射液態水時,一個水分子能釋放出一個電子,同時產生一種陽離子。產生的陽離子具有較強的氧化性,試寫出該陽離子與SO2的水溶液反應的離子方程式__________;該陽離子還能與水作用生成羥基,經測定此時的水具有酸性,寫出該過程的離子方程式____________________。
(3)水的性質中的一些特殊現象對于生命的存在意義非凡,請解釋水的分解溫度遠高于其沸點的原因______________________;試從結構的角度分析固態水(冰)的密度小于液態水的密度的原因是___________________________。
(4)甲烷的氣體水合物晶體稱為可燃冰,存在于海底和冰川底部,是巨大的潛在能源。在可燃冰晶體中,甲烷分子裝在水分子構成的籠內,假設可燃冰晶體中的水籠里裝的都是甲烷,理想的可燃冰晶胞組成為8CH4·46H2O,X-射線衍射分析表明,可燃冰晶體屬于立方晶體,晶胞參數a=1200pm。則該晶體的密度為________g/cm3(計算結果保留兩位有效數字)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質,不能按如圖(“→”表示反應一步完成)關系轉化的是

選 項 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | Al | Al(OH)3 | Al2O3 |
C | AlCl3 | Al(OH)3 | NaAlO2 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在給定條件下,下列選項所示的物質間轉化均能實現的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com