
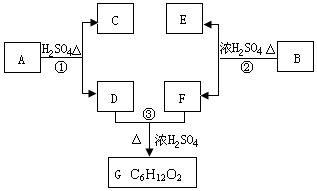
 A、B、C、D、E、F和G都是有機化合物,它們的關系如圖所示:
A、B、C、D、E、F和G都是有機化合物,它們的關系如圖所示: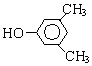 或
或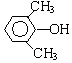 或
或 (寫出一種即可).
(寫出一種即可). 或
或
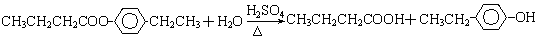 .①反應的反應類型取代反應
.①反應的反應類型取代反應 或
或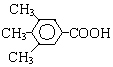 .
. 分析 化合物C的分子式是C8H10O,C遇FeCl3溶液顯紫色,說明C中含有酚-OH.由于C苯環上的一溴代物只有兩種,所以剩余的2個C原子與H原子組成2個-CH3或一個CH3CH2-.C的結構簡式為: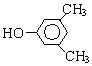 或
或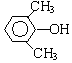 或
或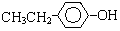 ,其式量為122,D為一直鏈化合物,其相對分子質量比化合物C的小34,則D的式量為88,能與NaHCO3反應生成CO2,說明D為羧酸.由羧酸的通式CnH2nO2可知,n=4,所以D的分子式為C4H8O2.由于D為直鏈化合物,其結構簡式為CH3CH2CH2COOH.所以A的結構簡式為:
,其式量為122,D為一直鏈化合物,其相對分子質量比化合物C的小34,則D的式量為88,能與NaHCO3反應生成CO2,說明D為羧酸.由羧酸的通式CnH2nO2可知,n=4,所以D的分子式為C4H8O2.由于D為直鏈化合物,其結構簡式為CH3CH2CH2COOH.所以A的結構簡式為: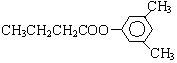 或
或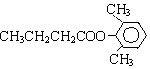 或
或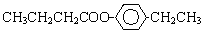 ,D和F發生酯化反應生成G為C6H12O2,F結構簡式為CH3CH2OH,芳香族化合物B是與A具有相同官能團的同分異構體,由C12H16O2+H2O→C2H6O+E可知,E的分子式為:C10H12O2,由于E苯環上的一溴代物只有一種,所以E的結構簡式可能為:
,D和F發生酯化反應生成G為C6H12O2,F結構簡式為CH3CH2OH,芳香族化合物B是與A具有相同官能團的同分異構體,由C12H16O2+H2O→C2H6O+E可知,E的分子式為:C10H12O2,由于E苯環上的一溴代物只有一種,所以E的結構簡式可能為: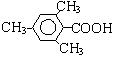 或
或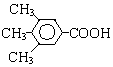 .
.
解答 解:(1)化合物C的分子式是C8H10O,C遇FeCl3溶液顯紫色,說明C中含有酚-OH.由于C苯環上的一溴代物只有兩種,所以剩余的2個C原子與H原子組成2個-CH3或一個CH3CH2-,C的結構簡式為: 或
或 或
或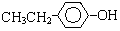 ,
,
故答案為: 或
或 或
或 ;
;
(2)C的式量為122,D為一直鏈化合物,其相對分子質量比化合物C的小34,則D的式量為88,能與NaHCO3反應生成CO2,說明D為羧酸.由羧酸的通式CnH2nO2可知,n=4,所以D的分子式為C4H8O2.由于D為直鏈化合物,其結構簡式為CH3CH2CH2COOH,
故答案為:CH3CH2CH2COOH;
(3)A的結構簡式為: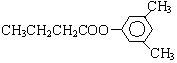 或
或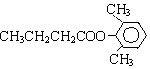 或
或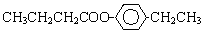 ,化合物C的分子式是C8H10O,C的結構簡式為:
,化合物C的分子式是C8H10O,C的結構簡式為: 或
或 或
或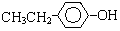 ,A水解生成C和D,D為直鏈化合物,其結構簡式為CH3CH2CH2COOH,所以反應①為:
,A水解生成C和D,D為直鏈化合物,其結構簡式為CH3CH2CH2COOH,所以反應①為: 或
或
或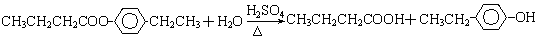 ,水解反應屬于取代反應,
,水解反應屬于取代反應,
故答案為: 或
或
或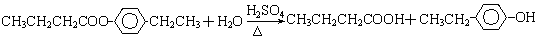 ;取代反應;
;取代反應;
(4)I.D和F發生酯化反應生成G為C6H12O2,F結構簡式為CH3CH2OH,其官能團為-OH,名稱為羥基,
故答案為:羥基;
II.芳香族化合物B是與A具有相同官能團的同分異構體,由C12H16O2+H2O→C2H6O+E可知,E的分子式為:C10H12O2,由于E苯環上的一溴代物只有一種,所以E的結構簡式可能為: 或
或 ,
,
故答案為: 或
或 .
.
點評 本題考查有機物推斷,關鍵是根據C、D發生的反應判斷含有的官能團,再結合分子式與結構特點確定C、D的結構,需熟練掌握官能團的性質與轉化,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | NH4Cl是電解質,所以NH4Cl溶液是電解質 | |
| B. | Al2O3是兩性氧化物,所以它能溶解于鹽酸也能溶于氨水中 | |
| C. | 用FeCl3溶液制作印刷電路板的原因是Fe3+具有氧化性 | |
| D. | Fe(OH)3膠體的本質特征是能產生丁達爾效應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 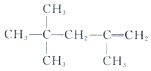 的名稱為:2,2,4-三甲基-4-戊烯 的名稱為:2,2,4-三甲基-4-戊烯 | |
| B. | 碳原子數小于或等于8的單烯烴,與HBr加成反應的產物只有一種結構,符合條件的單烯烴有6種 | |
| C. | 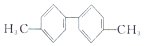 分子中至少有10個碳原子處于同一平面 分子中至少有10個碳原子處于同一平面 | |
| D. | 1 mol β-紫羅蘭酮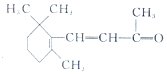 與1 mol H2發生加成反應可得到3種不同產物 與1 mol H2發生加成反應可得到3種不同產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
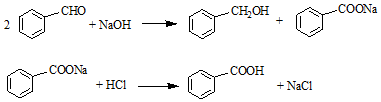
| 名稱 | 分子量 | 性狀 | 相對密度 (g•cm-3) | 沸點 (℃) | 溶解度 | ||
| 水 | 乙醚 | ||||||
| 苯甲醛 | 106 | 無色液體 | 1.04 | 179 | 微溶 | 易溶 | |
| 苯甲酸 | 122 | 無色晶體 | 1.27 | 249 | 0.21g | 66g | |
| 苯甲醇 | 108 | 無色液體 | 1.04 | 205 | 微溶 | 易溶 | |
| 乙醚 | 74 | 無色液體. | 0.71 | 35 | 不溶 | -- | |
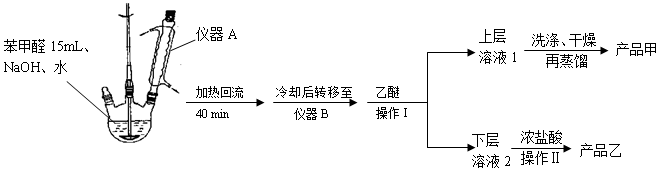
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫化鈉的水解反應:S2-+H3O+═HS-+H2O | |
| B. | 等物質的量的溴化亞鐵跟氯氣反應:Fe2++2Br-+C12═Fe3++Br2+2Cl- | |
| C. | 向NaHSO3溶液中加人少量Ba(OH)2溶液:2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O | |
| D. | 將Fe2O3溶于氫碘酸中:Fe2O3+6H+═2Fe3++3H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
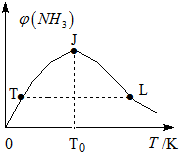 氫氣是新型能源和重要化工原料.
氫氣是新型能源和重要化工原料.| 容器編號 | 起始時各物質的物質的量/mol | 平衡時反應中的能量變化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3n | n | 0 | 放出熱量a kJ |
| Ⅱ | 3n | 2n | 0 | 放出熱量b kJ |
| Ⅲ | 6n | 2n | 0 | 放出熱量c kJ |
| 時間/min | 0 | 5 | 10 | 15 | 20 | 25 | … |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | CH3OH | CH3OCH3 | H2O |
| 濃度/mol•L-1 | 0.64 | 0.50 | 0.50 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 純凈水 | B. | 0.lmol/LHCl | C. | 1.0mol/LCH3COOH | D. | 0.5mol/LH2SO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 向100mL 3mol•L-1硫酸鋁銨【NH4Al(SO4)2】溶液中逐滴加入1mol•L-1Ba(OH)2溶液.
向100mL 3mol•L-1硫酸鋁銨【NH4Al(SO4)2】溶液中逐滴加入1mol•L-1Ba(OH)2溶液.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com