
【題目】下列實驗、實驗現象和相應結論都正確的是
實驗 | 現象 | 結論 | |
A | 向1mL | 溶液分層,上層溶液顯紫色。 | 氧化性:Fe3+>I2 |
B | 將兩塊表面積相等的Mg條和Al條放入同濃度同體積的NaOH溶液中。 | Al條產生氣泡的速度快。 | 金屬性:Al>Mg |
C | 向燒杯中加入一定體積蒸餾水,加熱至沸騰時,向其中逐滴滴加飽和FeCl3溶液。 | 得到紅褐色透明液體。 | 制得了氫氧化鐵膠體。 |
D | 向盛有10 mL溴水的分液漏斗中加入10mL苯,振蕩、靜置。 | 溶液分為兩層,上層為橙色。 | 溴在苯中的溶解能力大于水中。 |
A. A B. B C. C D. D
【答案】CD
【解析】A、三價鐵離子能把碘離子氧化為單質碘,2Fe3++2I-=2Fe2++I2,即FeCl3與KI發生了氧化還原反應,有I2生成,Fe3+作氧化劑,氧化性大于氧化產物I2,但溶液分層,下層溶液顯紫色,故A錯誤;B、將兩塊表面積相等的Mg條和Al條放入同濃度同體積的NaOH溶液中,只有鋁能與堿反應,不能以此來比較金屬性強弱,故B錯誤;C、向燒杯中加入一定體積蒸餾水,加熱至沸騰時,向其中逐滴滴加飽和FeCl3溶液,得到紅褐色透明液體,是氫氧化鐵膠體,故C正確;D、向盛有10 mL溴水的分液漏斗中加入10mL苯,振蕩、靜置,溶液分為兩層,上層為橙色,溴在苯中的溶解度大于水,故D正確。故選CD。


科目:高中化學 來源: 題型:
【題目】某同學做元素性質遞變規律實驗時,設計了一套實驗方案,記錄了有關實驗現象。
實驗步驟 | 實驗現象 |
① 將鎂條用砂紙打磨后,放入試管中,加入少量水后,加熱至水沸騰;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四處游動,發出“嘶嘶”聲,隨之消失,溶液變成紅色 |
②將一小塊金屬鈉放入滴有酚酞溶液的冷水中 | B.有氣體產生,溶液變成淺紅色 |
③將鎂條投入稀鹽酸中 | C.反應不十分劇烈;產生無色氣體 |
④將鋁條投入稀鹽酸中 | D.劇烈反應,迅速產生大量無色氣體 |
請幫助該同學整理并完成實驗報告。
(1)實驗目的:研究_________________元素性質遞變規律。
(2)實驗內容:(填寫與實驗步驟對應的實驗現象的編號)
實驗內容 | ① | ② | ③ | ④ |
實驗現象(填A~D) | _________ | ______ | _______ | ___________ |
(3)寫出實驗①\②對應化學方程式
實驗① ______________________________________________________________________,
實驗②_______________________________________________________________________。
(4)實驗結論:______________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常見的太陽能電池有單晶硅太陽能電池、多晶硅太陽能電池、GaAs太陽能電池及銅銦鎵硒薄膜太陽能電池等。
(1)Cu+在基態時的價電子排布式為__________________。
(2)砷、硒是第四周期的相鄰元素,已知砷的第一電離能大于硒。請從原子結構的角度加以解釋___________________________。
(3)GaAs熔點1238℃,難溶于溶劑。其晶體類型為_____________。
(4)AsF3的空間構型是:______________。
(5)硼酸(H3BO3)本身不能電離出H+,在水中易結合一個OH-生成[B(OH)4]-,而體現弱酸性。
①[B(OH)4]-中B原子的雜化類型為________。
②[B(OH)4]-的結構式為____________________。
(6)金剛石的晶胞如圖,若以硅原子代替金剛石晶體中的碳原子,便得到晶體硅:若將金剛石晶體中一半的碳原子換成硅原子,且碳、硅原子交替,即得到碳化硅晶體(金剛砂)。

①金剛石、晶體硅、碳化硅的熔點由高到低的排列順序是_______________________(用化學式表示)。
②立方氮化硼(BN)晶體的結構與金剛石相似,硬度與金剛石相當,立方氮化硼的密度是ρ g·㎝-3,,則晶胞邊長為___________。(只要求列算式,不必計算出數值,阿伏伽徳羅常數為NA)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表列出了A~R九種元素在周期表的位置:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | E | R | F | |||||
3 | A | C | D | H | I | G | ||
4 | B |
(1)寫出R單質分子的電子式____________。
(2)A、C、D三種元素的氧化物對應的水化物中堿性最強的是_________________ (填化學式)
(3)A、B、C三種元素的陽離子按離子半徑由大到小的順序排列為 __________________(用元素的離子符號表示)
(4)寫出A的單質與水反應的化學方程式____________________
(5)X元素是A~R九種元素中的一種,X的原子核里有14個中子,2.7gX在氧氣里燃燒時,質量增加2.4g。X的氫氧化物既能溶于氫氧化鈉溶液中反應,也能與鹽酸反應。
X的元符號是_______________,它位于元素周期表中______________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組中的離子,能在溶液中大量共存的是( )
A.H+、ClO-、Cl-、SO42-B.Na+、H+、CO32-、NO3-
C.Na+、H+、Cl-、NO3-D.K+、H+、SO42-、OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)①在BF3分子中,F—B—F的鍵角是________,B原子的雜化軌道類型為________,BF3和過量NaF作用可生成NaBF4,BF![]() 的立體構型為________;
的立體構型為________;
②在與石墨結構相似的六方氮化硼晶體中,層內B原子與N原子之間的化學鍵為________,層間作用力為________。
(2)①Y2X2(C2H2)分子中Y原子軌道的雜化類型為______,1 mol Y2X2含有σ鍵的數目為______。
②元素Y(C)的一種氧化物與元素Z(N)的一種氧化物互為等電子體,元素Z的這種氧化物的分子式為________。
③化合物ZX3(NH3)的沸點比化合物YX4(CH4)的高,其主要原因是______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗測得不同物質中O—O鍵的鍵長和鍵能數據如下表。其中X、Y的鍵能數據尚未測定,但可根據規律性推導鍵能的大小順序為W>Z>Y>X。
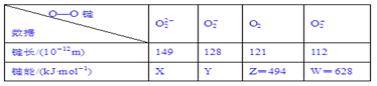
(1)鍵長與鍵能的關系規律是_________________________________________。
(2)鍵長與電子總數的關系規律是______________________________________。
(3)鍵能與電子總數的關系規律是_______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列分子中的中心原子雜化軌道的類型相同的是( )
A. CO2與SO2 B. CH4與NH3 C. BeCl2與BF3 D. C2H2與C2H4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】據報道,用甲酸提供氫氣的燃料電池由瑞士科技工作者開發成功。燃料電池包括兩個部分:甲(HYFORM)中使用釕(Ru)基催化劑從甲酸中產生氫氣;乙(PEMFC)是以NaOH為電解質的氫氧燃料電池。裝置的原理示意圖如圖。下列有關說法錯誤的是( )

A. 該燃料電池使用的甲酸比氫氣更易儲存和運輸
B. Y室的電極反應式:O2+4H++4e-=2H2O
C. X室為負極室,Y室為正極室
D. 甲中消耗1mol甲酸,乙中轉移2mol電子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com