
【題目】下列各物質,按單質、化合物、混合物的順序排列的是
A. 干冰、鐵、膽礬B. 液態氧、氧化鈣、石灰水
C. 氮氣、氯化氫、燒堿D. 水、碘酒、熟石灰
科目:高中化學 來源: 題型:
【題目】已知溶液中可發生反應:2FeBr2+Br2=2FeBr3,現向100mL的FeBr2溶液中通入3.36LCl2(標準狀況),充分反應后測得溶液中Cl-和Br-的物質的量濃度相等,則原FeBr2溶液的物質的量濃度為( )
A. 2molL-1 B. 1molL-1 C. 0.4molL-1 D. 0.2molL-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將足量的二氧化錳與40 mL 10 mol/L濃鹽酸反應產生的氯氣同0.1 mol二氧化錳與足量的濃鹽酸反應產生的氯氣相比( )
A. 前者產生的Cl2多 B. 后者產生的Cl2多
C. 一樣多 D. 無法比較
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 由一種元素組成的物質一定是單質
B. 由兩種元素組成的物質一定是化合物
C. 化合物和堿性化合物屬于包含關系
D. 氧化物和酸、堿、鹽屬于包含關系
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳、氮和鋁的單質及其化合物在工農業生產和生活中有重要的作用.
(1)真空碳熱還原﹣氯化法可實現由鋁礦制備金屬鋁,其相關的熱化學方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)═6AlCl(g)+6CO(g)△H=akJmol﹣1
3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJmol﹣1
反應Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=kJmol﹣1(用含a、b的代數式表示);
(2)用活性炭還原法可以處理氮氧化物.某研究小組向某密閉容器中加入一定量的活性炭和NO,發生反應C(s)+2NO(g)N2(g)+CO2(g)△H=QkJmol﹣1 . 在T1℃時,反應進行到不同時間測得各物質的濃度如下:
時間(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10min內,NO的平均反應速率v(NO)= , T1℃時,該反應的平衡常數K=;
②30min后,只改變某一條件,反應重新達到平衡,根據上表中的數據判斷改變的條件可能是(填字母編號).
a.通入一定量的NO
b.加入一定量的活性炭
c.加入合適的催化劑
d.適當縮小容器的體積
③若30min后升高溫度至T2℃,達到平衡時,容器中NO、N2、CO2的濃度之比為3:1:1,則Q0(填“>”或“<”).
④在絕熱恒容條件下,能判斷該反應一定達到化學平衡狀態的依據是(填選項編號).
a.單位時間內生成2nmol NO(g)的同時消耗nmol CO2(g)
b.反應體系的溫度不再發生改變
c.混合氣體的密度不再發生改變
d.反應體系的壓強不再發生改變.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,下列各組離子在相應的條件下可能大量共存的是( )
A.能使pH試紙變紅的溶液中:CO32﹣、K+、Cl﹣、Na+
B.由水電離產生的c(OH﹣)=1×10﹣10 mol?L﹣1的溶液中:NO3﹣、Mg2+、Na+、SO42﹣
C.在 ![]() =1×1012的溶液中:NH4+、Fe2+、Cl﹣、NO3﹣
=1×1012的溶液中:NH4+、Fe2+、Cl﹣、NO3﹣
D.![]() =10﹣10 mol?L﹣1的溶液中:Na+、HCO3﹣、Cl﹣、K+
=10﹣10 mol?L﹣1的溶液中:Na+、HCO3﹣、Cl﹣、K+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A,B,C,D,E五種物質均含有同一元素,且A為單質,有如圖所示的轉化關系.則下列判斷不正確的是( )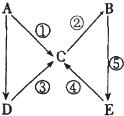
A.若ABCDE中同一元素的價態均不相同,則A為氣態單質
B.若A為金屬鈉,則由1molD完全反應生成C時,一定有1mol電子轉移
C.若A為非金屬硫,則④的反應類型既可以是氧化還原反應又可以是復分解反應
D.若A為金屬鐵,則化合物C和D均可以由化合反應生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵酸鹽MFe2O4與H2在高溫下反應生成新型納米材料氧缺位鐵酸鹽(MFe2Ox,3<x<4,M=Mn、Zn、Ni,其均顯+2價)。已知鐵酸鹽MFe2O4被H2高溫還原時,發生反應的MFe2O4與H2的物質的量之比為2:1。則下列說法中不正確的是
A. MFe2Ox是還原產物
B. MFe2Ox 中的+2價鐵和+3價鐵的物質的量之比為1:3
C. x=3.5
D. 若反應中消耗H2(標準狀況下)33.6L,則轉移的電子為3mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com