
【題目】X,Y,Z是三種短周期的主族元素,在周期表的位置如圖,X原子的最外層電子數是其次外層電子數的3倍,下列說法正確的是( ) 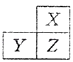
A.原子半徑:Y>Z>X
B.氣態氫化物的熱穩定性:X<Z
C.y和z的最高價氧化物對應水化物均為強酸
D.若z的最高正價為+m,則X的最高正價也一定為+m
【答案】A
【解析】解:X、Y、Z是三種短周期的主族元素,由各元素在周期表中的位置可知,X處于第二周期,Y、Z處于第三周期.X原子的最外層電子數是其次外層電子數的3倍,則X最外層電子數為6,故X為氧元素,Z為硫元素,Y為磷元素.A、同周期隨原子序數增大,原子半徑減小,所以原子半Y>Z,同主族自上而下,原子半徑增大,所以原子半徑Z>X,故原子半徑Y>Z>X,故A正確;
B、同主族自上而下,非金屬性減弱,所以非金屬性X>Z,非金屬性越強,氫化物越穩定,所以氣態氫化物的熱穩定性X>Z,故B錯誤;
C、硫酸是強酸,磷酸屬于中強酸,故C錯誤;
D、硫元素的最高正價為+6價,氧元素一般沒有正化合價,故D錯誤.
故選:A.
X、Y、Z是三種短周期的主族元素,由各元素在周期表中的位置可知,X處于第二周期,Y、Z處于第三周期.X原子的最外層電子數是其次外層電子數的3倍,則X最外層電子數為6,故X為氧元素,Z為硫元素,Y為磷元素.結合元素周期律進行解答.


 提分百分百檢測卷系列答案
提分百分百檢測卷系列答案科目:高中化學 來源: 題型:
【題目】w g鐵粉和鋁粉的混合物,和過量的NaOH反應,然后過濾,將沉淀完全收集后,放蒸發皿中加熱,直至被加熱的物質質量不再變化,取出蒸發皿中的物質稱量仍為w g.求原混合物中鋁粉的質量分數是( )
A.30%
B.50%
C.70%
D.90%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質中,第一種是含氧酸,第二種是混合物,第三種是堿的是( )
A. 爆鳴氣、硫酸銅、硫酸 B. 水、空氣、純堿
C. 硝酸、石灰石、燒堿 D. 氧化鐵、膽礬、熟石灰
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗裝置的說法中正確的是( )
A.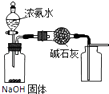
用如圖裝置制取干燥純凈的NH3
B.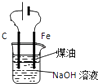
用如圖裝置制備Fe(OH)2并能較長時間觀察其顏色
C.
用如圖裝置可以完成“噴泉”實驗
D.
用如圖裝置測量Cu與濃硝酸反應產生氣體的體積
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
A.原電池外電路中電子由負極流向正極
B.原電池中發生還原反應的電極是正極
C.電解池中發生還原反應的電極是陽極
D.電解池中質量增加的電極是陰極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知Ca3(PO4)2與SiO2、C高溫共熱可以反應得到CaSiO3、P4蒸氣和CO.反應如下: Ca3(PO4)2+SiO2+C ![]() CaSiO3+P4↑+CO↑
CaSiO3+P4↑+CO↑
(1)配平該反應方程式,并標出電子轉移方向和數目. Ca3(PO4)2+SiO2+C ![]() CaSiO3+P4↑+CO↑
CaSiO3+P4↑+CO↑
(2)該反應中被還原的元素是 , 氧化產物是 .
(3)每消耗24.0g碳時,有個電子發生轉移,生成P4g.
(4)反應所得混合氣體,折算成標況下,其氣體密度為g/L(保留兩位小數).與該反應中涉及到的磷元素相同主族的氮元素,是造成水體富營養化的主要原因.若某污水中NH4Cl含量為180mg/L.
(5)寫出NH4Cl的電子式 .
(6)為除去廢水中的NH4+ , 向103L該污水中加入0.1mol/LNaOH溶液,發生如下反應:NH4++OH﹣→NH3+H2O.則理論上需要NaOH溶液的體積為L(計算結果保留兩位小數)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中不正確的是 ( )
A. 摩爾質量的常用單位為g·mol-1
B. 阿伏加德羅常數約為6.02×1023 mol-1
C. 二氧化硫的摩爾質量為64 g·mol-1
D. 摩爾質量就是相對原子質量的6.02×1023倍
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com