
下表為元素周期表中短周期的一部分,其中Y元素的原子序數為M與N元素原子序數之和。下列說法正確的是
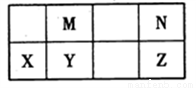
A. 氫化物的穩定性:N >Z,是因為其氫化物分子可形成氫鍵
B. 元素的非金屬性:M > Y,是因為單質M能與YN2反應生成單質Y
C. 熔沸點:YN2>MN2,是因為YN2的分子間作用力強
D. 簡單離子的半徑:N >X,是因為它們具有相同的電子層結構且X的核電荷數更大
科目:高中化學 來源:2017屆湖南省、衡陽八中等十三校重點中學高三第一次聯考化學試卷(解析版) 題型:選擇題
中國古代化學成績斐然,下列說法錯誤的是
A. 古代造紙是以木材等為原料,用去除雜質后的纖維素制成的,纖維素屬子天然高分子
B. 火藥是由硫磺、木炭、硝酸鉀按照一定比例混合制得的
C. “China”來源于聞名于世的我國陶瓷,陶瓷是一種硅酸鹽產品
D. 司母戊鼎是商朝鑄造的青銅器,它是由純銅制作的
查看答案和解析>>
科目:高中化學 來源:2017屆河南省安陽市高三第二次模擬考試理綜化學試卷(解析版) 題型:簡答題
一種帶有多孔結構的鎳鋁合金對H2具有較強的吸附性,其高催化活性和熱穩定性使得該鎳鋁合金被用于很多工業過程中和有機合成反應中。下圖是以鎳黃鐵礦(主要成分為NiS、FeS等)為原料制備該鎳鋁合金的工藝流程圖:
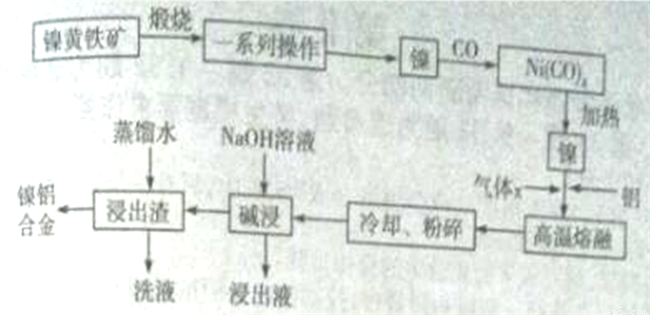
回答下列問題:
(1)Ni(CO)4中C、O化合價與CO中的C、O化合價相同,則Ni化合價為_______價。
(2)在空氣中“煅燒”生成Ni2O3和Fe2O3,寫出Fe2O3的化學方程式________________。
(3)操作“鎳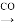 Ni(CO)4
Ni(CO)4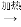 鎳”的目的是__________。
鎳”的目的是__________。
(4) Ni、Al高溫熔融時,氣體x的作用是___________。對“高溫熔融”物冷卻后,需要進行粉碎處理,粉碎處理的目的是________________。
(5)“堿浸”可以使鎳產生多孔結構,從而增強對H2的吸附性,“浸出液”中的主要離子是_____________;“浸出液”中的鋁元素可循環利用,寫出回收“浸出液”中的鋁元素,并制備“高溫熔融”時的原料Al的流程:_____________(示例:CuO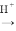 Cu2+
Cu2+ Cu)。
Cu)。
查看答案和解析>>
科目:高中化學 來源:2017屆四川省高三上學期第四次月考理科綜合化學試卷(解析版) 題型:選擇題
用NA表示阿伏加德羅常數的值。下列敘述中一定正確的是
A. 一定條件下某密閉容器盛2 mol N2與3 mol H2反應生成的NH3分子數為2NA
B. 25 ℃時,Ksp(BaSO4)=1×10-10,則BaSO4飽和溶液中Ba2+數目為1×10-5NA
C. 一定條件下4.6g Na完全與O2反應生成7.2 g產物,失去的電子數為0.2NA
D. 1 L 0.1mol·L-1的NaHCO3溶液中HCO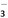 和CO
和CO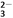 的離子數之和為0.1NA
的離子數之和為0.1NA
查看答案和解析>>
科目:高中化學 來源:2017屆湖北省黃岡市高三3月質量檢測理科綜合化學試卷(解析版) 題型:簡答題
NH3作為一種重要化工原料,被大量應用于工業生產,與其有關性質反應的催化劑研究曾被列入國家863計劃。
(1)催化劑常具有較強的選擇性,即專一性。已知:
反應I:4NH3(g) +5O2(g)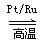 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反應II:4NH3(g)+3O2(g) 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
寫出NO分解生成N2與O2的熱化學方程式_____。
(2)在恒溫恒容裝置中充入一定量的NH3和O2,在某催化劑的作用下進行反應I ,測得不同時間的NH3和O2,的濃度如下表:
時間(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol• L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
則下列有關敘述中正確的是_____________。
A.使用催化劑時,可降低該反應的活化能,加快其反應速率
B.若測得容器內4v正(NH3) =6v逆(H2O)時,說明反應已達平衡
C.當容器內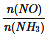 =1時,說明反應已達平衡
=1時,說明反應已達平衡
D.前10分鐘內的平均速率v( NO)=0.088 mol·L-1·min-1
(3)氨催化氧化時會發生上述兩個競爭反應I、II。為分析某催化劑對該反應的選擇性,在1L密閉容器中充入1 mol NH3和2mol O2,測得有關物質的量關系如下圖:
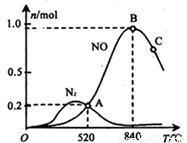
①該催化劑在低溫時選擇反應_______(填“ I ”或“ II”)。
②52℃時,4NH3+3O2 2N2+6H2O的平衡常數K=_______(不要求得出計算結果,只需列出數字計算式)。
2N2+6H2O的平衡常數K=_______(不要求得出計算結果,只需列出數字計算式)。
③C點比B點所產生的NO的物質的量少的主要原因________。
(4)制備催化劑時常產生一定的廢液,工業上常利用氫硫酸檢測和除去廢液中的Cu2+。
已知:25℃時,K1(H2S) =1.3×10-7,K1(H2S) =7.1×10-15,Ksp(CuS) =8.5×10-45
①在計算溶液中的離子濃度時,涉及弱酸的電離通常要進行近似處理。則0.lmol •L-1氫硫酸的pH≈______(取近似整數)。
②某同學通過近似計算發現0.lmol •L-1氫硫酸與0.0lmol •L-1氫硫酸中的c(S2-)相等,而且等于_____mol·L-1
③已知,某廢液接近于中性,若加入適量的氫硫酸,當廢液中c(Cu2+) >_____ mol·L-1(計算結果保留兩位有效數字),就會產生CuS沉淀。
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省長沙市長望瀏寧四縣高三3月模擬考試理綜化學試卷(解析版) 題型:推斷題
氯吡格雷是一種血小板聚集抑制劑,該藥物以2-氯苯甲醛為原料的合成路線如下:
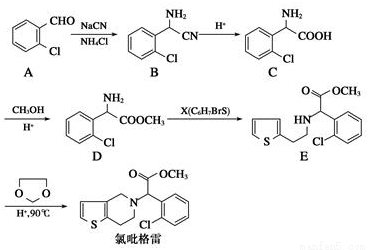
請根據以上信息,結合自己的掌握知識和具有的經驗回答下列問題:
(1)分子C中除氯原子外的官能團名稱為_________。
(2)X的結構簡式為____________。
(3)D→E的反應類型是__________反應。
(4)分子C在一定條件下生成一種含有3個六元環的產物的化學方程式_________________
(5)同時滿足下列兩個條件的B的同分異構體共有____種(不包括B)
①與B含有相同的官能團 ②苯環上的取代基不超過2個。
(6)已知: 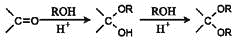 則由乙醇、甲醇為有機原料制備化合物
則由乙醇、甲醇為有機原料制備化合物 ,構成需要經歷的反應類型有_______ (填寫編號)。
,構成需要經歷的反應類型有_______ (填寫編號)。
①加成反應 ②消去反應 ③取代反應 ④氧化反應 ⑤還原反應,寫出制備化合物 的最后一步反應________________
的最后一步反應________________
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省長沙市長望瀏寧四縣高三3月模擬考試理綜化學試卷(解析版) 題型:選擇題
同周期的四種短周期元素X、Y、Z和W的原子序數依次遞增,其原子的最外層電子數之和為18,X和Y的原子序數比為6:7,X的最高正價是W的最低負價絕對值的2倍。下列說法正確的是
A. Y的氧化物不能與任何酸發生反應
B. X和W可形成離子化合物
C. X、Y、Z和W都沒有同素異形體
D. Z和W的最高價氧化物對應的水化物都是強酸
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省高一下學期第一次月考化學試卷(解析版) 題型:選擇題
用固體樣品配制一定物質的量濃度的溶液,需經過稱量、溶解、轉移溶液、定容等操作。下列圖示對應的操作規范的是( )
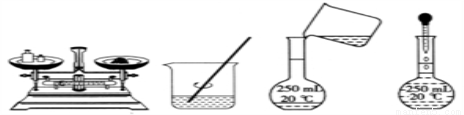
A. 稱量 B. 溶解 C. 轉移溶液 D. 定容
查看答案和解析>>
科目:高中化學 來源:2017屆江西省南昌市高三第一次模擬考試理綜化學試卷(解析版) 題型:選擇題
短周期主族元素X、Y、Z、W的原子序數依次增大,且只有一種元素為金屬元素。其中X、Z同主族.X、Y、Z的原子最外層電子數之和為15,則下列說法錯誤的是
A. Y、z、W一定同周期 B. 簡單氫化物穩定性:X>Z
C. X、Y組成的化合物具有兩性 D. 離子半徑大小:Z>W>Y>X
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com