
【題目】含釩石煤(含有鐵、硅、鋁、鈣、鎂等元素的氧化物)中的釩大部分是以V(III)和V(IV)形式存在,由含礬石煤提釩的一種工藝流程如圖所示:
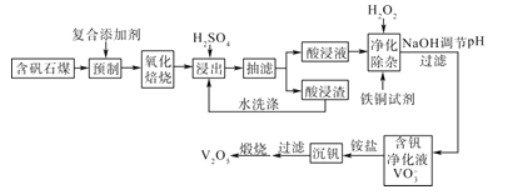
已知:銅鐵試劑能與銅、鐵、鋁、鈦等元素形成不溶于水的配合物。
回答下列問題:
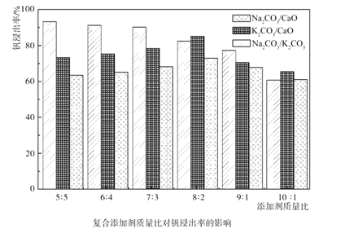
(1)含礬石煤預制時加入復合添加劑對釩浸出率的影響如圖所示,其中最佳復合添加劑為__,最佳添加比例為__。
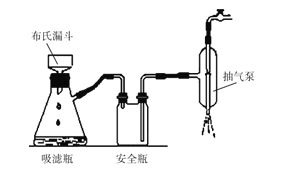
(2)如圖為“抽濾”實驗原理裝置圖,"抽濾”時抽氣泵的作用是__;“酸浸渣”經“水洗滌”返回“浸出”的目的是__。
(3)已知酸浸液中V2O24+被H2O2氧化成VO2+,其離子方程式為__。“凈化除雜”時用銅鐵試劑除去所含的Al3+、Fe3+等雜質離子而不通過調節酸浸液pH的原因是__。
(4)“沉釩”的離子反應方程式為___。
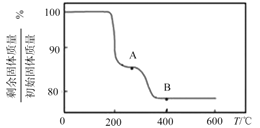
(5)“煅燒”純凈的沉釩產物過程中,固體殘留率與溫度變化如圖所示。已知A點坐標為(260℃,85.47%)。則A點對應物質的化學式為__,B點對應的物質為V2O5,則B點坐標為___。
【答案】Na2CO3/K2CO3 1:1 抽走裝置中的空氣,形成負壓,加快過濾速率 提高釩浸出率 ![]() 若調節酸浸液pH易生成Fe(OH)3、Al(OH)3膠體,膠體會吸附溶液中的釩酸根離子,造成釩損失
若調節酸浸液pH易生成Fe(OH)3、Al(OH)3膠體,膠體會吸附溶液中的釩酸根離子,造成釩損失 ![]() HVO3 (400℃,77.78%)
HVO3 (400℃,77.78%)
【解析】
(1)讀圖找出最佳復合添加劑及最佳添加比例;
(2)從從抽濾的原理來回答作用;“酸浸渣”經“水洗滌”返回“浸出”的目的從提高原料利用率的角度回答;
(3)結合氧化還原反應的規律寫離子方程式,“凈化除雜”時用銅鐵試劑除去所含的Al3+、Fe3+等雜質離子而不通過調節酸浸液pH的原因,從二種方法的優劣比較來回答;
(4)讀圖找到產生沉淀的反應物,據此寫“沉釩”的離子反應方程式;
(5)讀圖,結合質量守恒定律中元素質量守恒計算和化學反應規律回答。
(1)據圖可知,Na2CO3/K2CO3作復合添加劑時,釩浸出率最高,添加比例為1:1;
故答案為:Na2CO3/K2CO3;1:1;
(2)"抽濾"比過濾效果好速度快的原因是裝置內外壓強差大,是利用抽氣泵使吸濾瓶中的壓強降低,使過濾速度加快;
答案為:抽走裝置中的空氣,形成負壓,加快過濾速率;
“酸浸渣”經“水洗滌”返回“浸出"可提高釩元素的浸出率;
答案為:提高釩浸出率;
(3) V2O24+被H2O2氧化成VO2+,H2O2作氧化劑,其還原產物為水,則離子方程式為:![]() ;
;
答案為:![]() ;
;
按信息,銅鐵試劑能與銅、鐵、鋁、鈦等元素形成不溶于水的配合物而除去,若調節酸浸液pH易生成Fe(OH)3、Al(OH)3膠體,膠體會吸附溶液中的釩酸根離子,造成釩損失;
答案為:若調節酸浸液pH易生成Fe(OH)3、Al(OH)3膠體,膠體會吸附溶液中的釩酸根離子,造成釩損失;
(4)據流程圖知,“含釩凈化液”中的![]() 與銨鹽中
與銨鹽中![]() 結合生成
結合生成![]() 沉淀;
沉淀;
答案為:![]() ;
;
(5) 260℃時若分解生成HVO3和NH3,則剩余固體質量與初始固體質量的百分比為![]() ×100%≈85.47%,所以A點(260℃ )對應物質的化學式為HVO3;
×100%≈85.47%,所以A點(260℃ )對應物質的化學式為HVO3;
答案為:HVO3;
B點對應的物質為V2O5 ,根據質量變化特點,可以得出剩余固體質量與初始固體質量的百分比為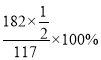 ≈77.78%,則B點坐標為(400℃,77.78%);
≈77.78%,則B點坐標為(400℃,77.78%);
答案為:(400℃,77.78%)。


科目:高中化學 來源: 題型:
【題目】(1)氫氧化鐵受熱分解化學方程式:___。
(2)Al(OH)3與NaOH溶液反應的離子方程式:___。
(3)鐵溶于鹽酸的離子方程式:___。
(4)Na2O2與CO2反應的化學方程式:___。
(5)乙烯的結構式:___。
(6)乙烯的電子式:___。
(7)Na2O2的電子式:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】幾種短周期元素的原子半徑及主要化合價如下表:已知X是短周期中最活潑的金屬,且與R同周期。(請用化學用語答題)
元素代號 | X | Y | Z | M | R |
原子半徑/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合價 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)R的元素符號為___,M在元素周期表中的位置為___。
(2)X與Y按原子個數比1∶1構成的物質的電子式為___,所含化學鍵類型___。
(3)X+、Y2-、M2-離子半徑大小順序為___。
(4)將YM2通入FeCl3溶液中的離子方程式:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年11月《Science》雜志報道了王浩天教授團隊發明的制取H2O2的綠色方法,原理如圖所示(已知:H2O2![]() H+ + HO2-,Ka=2.4×10-12)。下列說法錯誤的是
H+ + HO2-,Ka=2.4×10-12)。下列說法錯誤的是

A.a極的電勢低于b極
B.Y膜為選擇性陰離子交換膜
C.每轉移0.4 mol e-,就有0.1 mol H2O2生成
D.b極的電極反應為O2 + 2e- + H2O = HO2- + OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】連二亞硫酸鈉(Na2S2O4)俗稱保險粉,可用作食品保鮮劑(不直接加入食品中,安全、衛生),還可用于紙漿、肥皂等的漂白劑。Na2S2O4易溶于水,難溶于乙醇。在堿性介質中較穩定,在空氣中易被氧化。回答下列問題:
(1)Na2S2O4用于保鮮劑時能去除O2,先生成Na2SO3并緩慢釋放SO2,該反應的化學方程式為________。
(2)鋅粉法制備Na2S2O4的工藝流程如圖所示:
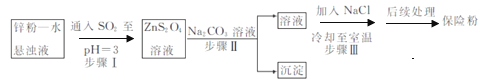
①實驗室可用濃硫酸和亞硫酸鈉反應制取SO2,并希望能控制反應速度,圖中可選用的發生裝置是________(填字母)。
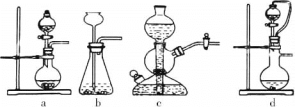
②工業上常將鋅塊進行預處理得到鋅粉—水懸濁液,其目的是_______。步驟Ⅱ中發生反應的化學方程式為___。
③在步驟.中得到的Na2S2O4固體要用乙醇洗滌,其優點是_______。
(3)目前,我國普遍采用甲酸鈉法生產連二亞硫酸鈉,其原理是先將HCOONa和燒堿加人乙 醇水溶液液中,然后通入SO2發生反應,有CO2氣體放出,總反應的化學方程式是___________。
(4)連二亞硫酸鈉的分析檢測。鐵氰化鉀法:鐵氰化鉀K3[Fe(CN)6]是一種比較弱的氧化劑,其具有強氧化劑所沒有的選擇性氧化性,能將S2O42-氧化為SO32-,[Fe(CN)6]3-還原為[Fe(CN)6]4-。取50.00mLNa2S2O4樣品溶液,用0.02molL-1的K3[Fe(CN)6]標準液滴定至終點,消耗10.00mL。該樣品中Na2S2O4的含量為_______gL-1。(以SO2計)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Cu2O是重要的催化劑和化工原料,工業上制備Cu2O的主要反應如下:
①C(s)+CO2(g)2CO(g) ΔH=+172.5 kJ·mol-1
②CO(g)+2CuO(s) Cu2O(s)+CO2(g) ΔH=-138.0 kJ·mol-1
(1)C與CuO反應生成Cu2O和CO的熱化學方程式為_______。
(2)一定溫度下,向5L恒容密閉容器中加入1molCO和2 molCuO,發生反應②,5 min時達到平衡,測得容器中CuO的物質的量為0.8mol。
①0~5 min內,用CO2表示的反應速率v(CO2)=____。
②CO的平衡轉化率α=_______。
(3)向5L密閉容器中加入1molC和1molCO2,發生反應①,CO2、CO的平衡體積分數(φ)與溫度(T)的關系如圖所示:
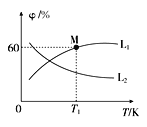
①能表示CO2的平衡體積分數與溫度關系的曲線為____(填“L1”或“L2”),理由為_______。
②溫度為T1時,該反應的平衡常數K=_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲烷水蒸氣的重整反應是工業制備氫氣的重要方式,其化學反應方程式為CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列問題:
CO(g)+3H2(g)。回答下列問題:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H1=-890.3kJ·mol-1
CO(g)+![]() O2(g)=CO(g) H2=-283.0kJ·mol-1
O2(g)=CO(g) H2=-283.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) H3=-285.8kJmol-1
O2(g)=H2O(l) H3=-285.8kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1
則甲烷水蒸氣重整反應的△H=__kJ·mol-1。
(2)通過計算機模擬實驗,對400~1200℃、操作壓強為0.1MPa條件下,不同水碳比(1~10)進行了熱力學計算,反應平衡體系中H2的物質的量分數與水碳比、平衡溫度的關系如圖所示。
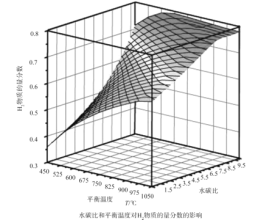
①H2的物質的量分數與水碳比(1~10)的關系是平衡溫度一定時,__;其原因是__。
②據模擬實驗可知,平衡溫度為900℃,水碳比為1.0時,H2的物質的量分數為0.6,CH4的轉化率為__,其壓強平衡常數為__;反應速率方程為v=kp(CH4)p-1(H2),此時反應速率=__(已知:氣體分壓=氣體的物質的量分數×總壓,速率方程中k為速率常數)。
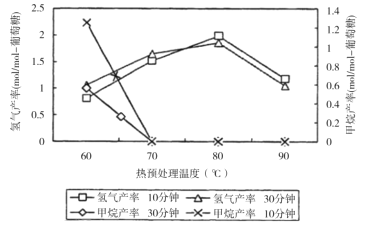
(3)厭氧細菌可將葡萄糖轉化為CH4和H2,pH為5.5時不同熱預處理溫度和時間下的甲烷和氫氣的產率如圖所示,若要提高H2的產率,最佳溫度為__;與甲烷水蒸氣重整制氫相比其優點有__(至少寫兩點)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有機化學反應方程式及反應類型均正確的是
選項 | 化學反應方程式 | 反應類型 |
A | CH3COOH+CH3CH2OH | 酯化反應 |
B | CH4+Cl2 | 置換反應 |
C | CH2=CH2+Br2 CH3CHBr2 | 加成反應 |
D |
| 取代反應 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某NiO的廢料中有FeO、CuO、Al2O3、MgO、SiO2等雜質,用此廢料提取NiSO4和Ni的流程如下:
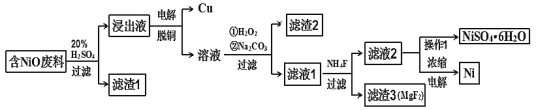
已知:有關金屬離子生成氫氧化物沉淀所需的pH如圖:

(1)濾渣1的主要成分為____。
(2)①用離子方程式解釋加入H2O2的作用____。
②加Na2CO3調節溶液的pH至5,則濾渣2的主要成分為____。
(3)從濾液2中獲得NiSO4·6H2O的實驗操作是____、過濾、洗滌、干燥。
(4)電解濃縮后的濾液2可獲得金屬鎳,其基本反應原理示意圖如圖:
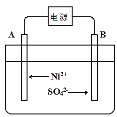
①B極附近pH會____(填“增大”、“減小”或“不變”);用平衡移動原理解釋B極附近pH變化的原因:____。
②一段時間后,在A、B兩極均收集到11.2L氣體(標準狀況下),理論上能得到Ni____g。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com