
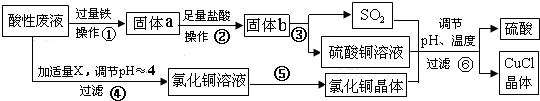
分析 從某酸性廢液(主要含Cu2+、Fe3+、H+、Cl-)中制備氯化亞銅,向工業(yè)上以某酸性廢液(含Cu2+、Fe3+、H+、Cl-)加入過量的鐵粉,三價鐵離子與鐵粉反應轉化為二價鐵離子,銅離子與鐵反應生成銅,然后過濾,濾渣為過量的鐵和生成的銅,依據銅與鐵活潑性,將濾渣溶于鹽酸,銅與鹽酸不反應,過濾得到濾渣即為銅,然后銅與濃硫酸反應生成硫酸銅和二氧化硫,酸性廢液調節(jié)pH值使鐵離子沉淀,過濾得氯化銅溶液,氯化銅、硫酸銅、二氧化硫反應生成氯化亞銅和硫酸,硫酸可以再循環(huán)利用,
(1)步驟②中從溶液中分離出固體物質過量的鐵和生成的銅;
(2)步驟④中為調節(jié)溶液的pH值,要能與酸反應同時不引入新的雜質,據此確定所加物質X;
(3)CuCl微溶于水、不溶于乙醇及稀硫酸,所以要用乙醇洗滌CuCl晶體;
(4)根據流程分析可知,硫酸可以循環(huán)利用,根據反應中硫元素守恒判斷是否需要補充硫酸;
(5)電解CuCl2溶液,陰極上是銅離子得電子生成亞銅離子,亞銅離子結合氯離子生成氯化亞銅沉淀.
解答 解:(1)步驟②中從溶液中分離出固體物質過量的鐵和生成的銅,所以步驟②的操作名稱是過濾、洗滌,
故答案為:過濾、洗滌;
(2)步驟④中為調節(jié)溶液的pH值,要能與酸反應同時不引入新的雜質,所以物質X為CuO或Cu (OH)2或CuCO3等,
故答案為:CuO或Cu (OH)2或CuCO3等;
(3)CuCl微溶于水、不溶于乙醇及稀硫酸,所以要用乙醇洗滌CuCl晶體,減少CuCl的損失,
故答案為:減少CuCl的損失;
(4)根據流程分析可知,硫酸可以循環(huán)利用,Cu與濃硫酸反應生成CuSO4和 SO2的物質的量為1:1,而生產CuCl的過程中消耗CuSO4和SO2的物質的量也為1﹕1,所以理論上不需要補充H2SO4,
故答案為:否;
(5)電解CuCl2溶液,陰極上是銅離子得電子生成亞銅離子,亞銅離子結合氯離子生成氯化亞銅沉淀,電極反應式為 Cu2++Cl-+e-=CuCl↓,
故答案為:Cu2++Cl-+e-=CuCl↓.
點評 本題考查了CuCl的生產工藝流程,為高考熱點和難點,涉及物質的分離、物質的制備,明確物質的性質是解題關鍵,注意物質性質的理解應用,題目難度中等.


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:選擇題
| A. | 弱堿性溶液中:Na+、K+、Cl-、HCO3- | |
| B. | “84”消毒液中:SiO32-、CO32-、Na+、S2- | |
| C. | 使酚酞變紅色的溶液中:Na+、Al3+、SO42-、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol NH3所含有的電子數為17NA | |
| B. | 常溫常壓下,22.4 L氧氣所含的原子數為2NA | |
| C. | 常溫常壓下,48g O3所含的氧原子數為3NA | |
| D. | 1 mol/L NaCl溶液中所含的Na+數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SiH4的沸點高于CH4,推測HCl的沸點高于HF | |
| B. | Fe與CuSO4溶液反應置換出Cu,故Na也能從CuSO4溶液中置換出Cu | |
| C. | 電解熔融NaCl制取Na,故電解熔融MgCl2也能制取Mg | |
| D. | CO2和Na2O2反應生成Na2CO3和O2,故SO2和Na2O2反應生成Na2SO3和O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學反應中1 mol金屬鎂變成鎂離子時失去電子的數目為2NA | |
| B. | 28 g氮氣所含有的原子數目為NA | |
| C. | 標準狀況下,22.4 L水中含有NA個水分子 | |
| D. | 標準狀況下,22.4 L氯化氫所含的原子數為NA |
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com