
【題目】現有下列十種物質:① 液態氯化氫 ②小蘇打③ 固體純堿 ④ 二氧化碳 ⑤蔗糖 ⑥ 氫氧化鉀 ⑦氫氧化鐵膠體 ⑧ 氨水 ⑨空氣 ⑩ 硫酸鐵溶液
(1)上述十種物質中,屬于電解質的有_________,屬于非電解質的有_____________。
(2)有兩種物質在水溶液中可發生反應,離子方程式為H++OH-=H2O,該反應的化學方程式為_______。
(3)除去③中少量②的操作是________,化學方程式為_____________。
(4)標準狀況下,_________L④中含有0.4mol氧原子。
(5)現有100mL⑩溶液中含Fe3+5.6g,則溶液中SO42-的物質的量濃度是____________。
【答案】(1)①②③⑥,④⑤
(2)HCl+KOH=KCl+H2O
(3)加熱,2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(4)4.48(5)1.5mol/L
【解析】
試題分析:(1)溶于水或在熔融狀態下能夠自身電離出離子的化合物是電解質,因此屬于電解質的有液態氯化氫、小蘇打、固體純堿、氫氧化鉀;溶于水和在熔融狀態下都不能夠自身電離出離子的化合物是非電解質,因此屬于非電解質的有二氧化碳、蔗糖。
(2)有兩種物質在水溶液中可發生反應,離子方程式為H++OH-=H2O,這說明應該是強酸和強堿反應且生成可溶性鹽,則該反應的化學方程式為HCl + KOH = KCl + H2O。
(3)碳酸氫鈉受熱易分解生成碳酸鈉,則除去③中少量②的操作是加熱,反應的化學方程式為2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(4)1molCO2含有2mol氧原子,則0.2molCO2含有0.4mol氧原子,在標準狀況下的體積為0.2mol×22.4L/mol=4.48L;
(5)5.6g鐵離子的物質的量是0.1mol,則根據硫酸鐵的化學式可知硫酸根的物質的量是0.15mol,濃度是0.15mol÷0.1L=1.5mol/L。


 心算口算巧算一課一練系列答案
心算口算巧算一課一練系列答案科目:高中化學 來源: 題型:
【題目】下列各組物質中化學鍵的類型相同的是( )
A.HCl MgCl2 NH4Cl
B.H2O Na2O CO2
C.CaCl2 NaOH H2S
D.NH3 H2O CO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制備硝基苯的方法是將苯與濃硫酸和濃硝酸的混合液加熱到 50~60℃反應。已知苯與硝基苯的基本物理性質如下表所示:


(1)要配制濃硫酸和濃硝酸的混合酸的注意事項是_________________。
(2)分離硝基苯和水的混合物的方法是_____________;分離硝基苯和苯的方法是_____________。
(3)某同學用如圖裝置制取硝基苯:
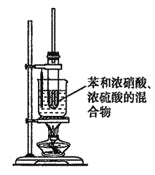
①用水浴加熱的優點是_________________;
②被水浴加熱的試管口部都要帶一長導管,其作用是_________________。
(4)寫出此反應的化學方程式____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )。
A. 氫原子光譜是元素的所有光譜中最復雜的光譜之一
B. “量子化”就是不連續的意思,微觀粒子運動均有此特點
C. 玻爾理論不但成功解釋了氫原子光譜,而且還推廣到其他原子光譜
D. 原子中電子在具有確定半徑的圓周軌道上像火車一樣高速運轉著
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗中,①pH試紙的使用 ②過濾 ③蒸發 ④配制一定物質的量濃度溶液,均用到的儀器是
A. 蒸發皿 B. 玻璃棒 C. 試管 D. 分液漏斗
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把6.5 g Zn放入500mL稀鹽酸中,Zn與HCl都恰好完全反應。計算:
(1)6.5 g Zn的物質的量_______________;
(2)生成的氣體在標準狀況下的體積_____________;
(3)原稀鹽酸的物質的量濃度_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.H2SO4和H3PO4的摩爾質量相等
B.2g氫氣中含有1 mol氫
C.O2的摩爾質量在數值上等于其一個分子的質量
D.1 mol CO的質量是28 g·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學體檢的血液化驗單中,出現了如下圖所示的體檢指標。表示該體檢指標的物理量是
甘油三酯 | 0.52 | mmol/L |
總膽固醇 | 4.27 | mmol/L |
高密度脂蛋白膽固醇 | 1.57 | mmol/L |
低密度脂蛋白膽固醇 | 1.40 | mmol/L |
葡萄糖 | 4.95 | mmol/L |
A.溶解度 B.物質的量濃度 C.質量分數 D.摩爾質量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在分析化學中常用Na2C2O4晶體作為基準物質測定KMnO4溶液的濃度。
(1)若將W g Na2C2O4配成100mL標準溶液,移取20.00mL置于錐形瓶中,則酸性KMnO4溶液應裝在______(填“酸式”或“堿式”)滴定管中,判斷滴定達到終點的現象是_________________。
(2)寫出KMnO4與熱的經硫酸酸化的Na2C2O4反應生成Mn2+和CO2的化學方程式:________________________。
(3)25℃時,用pH計測得0.10 mol·L-1草酸鈉溶液的pH=a,則H2C2O4的第二級電離平衡常數Ka2= 。
(4)CaC2O4是難溶于水的固體,受熱易分解,在一定溫度下向2L的密閉容器放入足量草酸鈣(固體所占體積忽略不計)發生反應: CaC2O4(s)![]() CaO(s)+CO(g)+CO2(g),若前5min內生成CaO的質量為16.8g,則該段時間內υ(CO)=__________mol·L-1·s-1;當反應達到平衡后,將容器體積壓縮到原來的一半,則下列說法正確的是__________(填答案選項編號)。
CaO(s)+CO(g)+CO2(g),若前5min內生成CaO的質量為16.8g,則該段時間內υ(CO)=__________mol·L-1·s-1;當反應達到平衡后,將容器體積壓縮到原來的一半,則下列說法正確的是__________(填答案選項編號)。
A.平衡不移動,CaO的質量不變
B.平衡發生移動,當CO的百分含量不變時達到新的平衡
C.平衡發生移動,但CO和CO2的濃度都沒有改變
D.平衡向逆反應方向移動,且該反應的化學平衡常數減小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com