
【題目】膠體區別于其它分散系的本質是()
A. 膠體粒子不能穿過半透膜,能通過濾紙空隙
B. 膠體粒子帶電荷并且在一定條件下能穩定存在
C. 膠體的分散質粒子直徑在1 nm~100nm之間
D. 膠體粒子能夠發生布朗運動而且能產生丁達爾現象
 中考解讀考點精練系列答案
中考解讀考點精練系列答案科目:高中化學 來源: 題型:
【題目】化學反應速率和限度與生產、生活密切相關。
(1)某學生為了探究鋅與鹽酸反應過程中的速率變化,在400mL稀鹽酸中加入足量的鋅粉,用排水集氣法收集反應放出的氫氣,實驗記錄如下(累計值):
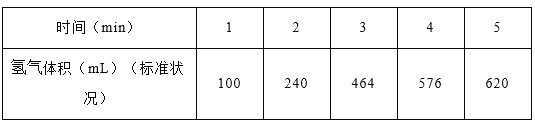
①哪一時間段反應速率最大______min(填0~1、1~2、2~3、3~4、4~5),原因是_____。
②求3~4分鐘時間段以鹽酸的濃度變化來表示的該反應速率_________(設溶液體積不變)。
(2)另一學生為控制反應速率防止反應過快難以測量氫氣體積,他事先在鹽酸中加入等體積的下列溶液以減慢反應速率,你認為不可行的是____。
A.蒸餾水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某溫度下在4L密閉容器中,X、Y、Z三種氣態物質的物質的量隨時間變化曲線如圖。
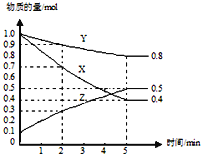
①該反應的化學方程式是_______。
②該反應達到平衡狀態的標志是______
A.Y的體積分數在混合氣體中保持不變
B.X、Y的反應速率比為3∶1
C.容器內氣體壓強保持不變
D.容器內氣體的總質量保持不變
E.生成1mol Y的同時消耗2mol Z
③2min內Y的轉化率為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用已知濃度鹽酸滴定未知濃度的NaOH溶液,以酚酞作指示劑,下列操作會使所測NaOH溶液濃度偏低的是( )
A.錐形瓶洗凈后還留有蒸餾水
B.取堿液的滴定管開始有氣泡,放出液體后氣泡消失
C.溶液顏色較淺時滴入酸液過快,停止滴定后反加一滴NaOH溶液無變化
D.用堿式滴定管取一定體積的NaOH溶液時,量取前仰視讀數,量取后俯視讀數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原電池是將化學能轉變為電能的裝置。關于下圖所示原電池的說法不正確的是
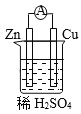
A. Cu為正極,Zn為負極 B. 電子由銅片通過導線流向鋅片
C. 正極反應式為2H+ + 2e- ![]() H2↑ D. 原電池的反應本質是氧化還原反應
H2↑ D. 原電池的反應本質是氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關幾種常見的金屬和非金屬及其化合物的說法正確的是( )
A.鋁熱反應是指鋁能將所有的金屬從其氧化物中置換出來
B.Na,Mg,Al,Fe,Cu都能導電,它們的氧化物都能與酸反應
C.CO2 , NO,SO2都是非金屬氧化物,都屬于酸性氧化物
D.CaCO3+SiO2 ![]() ?CaSiO3+CO2↑的發生,說明硅酸的酸性強于碳酸
?CaSiO3+CO2↑的發生,說明硅酸的酸性強于碳酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在100mL HNO3和H2SO4的混合溶液中,兩種酸的物質的量濃度之和為0.6mol/L。向該溶液中加入足量的銅粉,加熱,充分反應后,所得溶液中Cu2+的物質的量濃度最大值為(反應前后溶液體積變化忽略不計)
A. 0.225mol/L B. 0.30mol/L C. 0.36mol/L D. 0.45mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(10分)A、B、C是中學化學常見的三種物質,它們之間的相互轉化關系如下(部分反應條件及產物略去)。
![]()
(1)若A是一種活潑金屬,C是淡黃色固體,試用化學方程式表示該物質C的一個重要應用 ;
(2)若A是一種黃色單質固體,則B→C的化學方程式為 ;
(3)若A是一種黑色非金屬單質固體,寫出B的一個用途 ;
(4)若C是紅棕色氣體,則A化學式可能為 ,試寫出C與水反應的化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把7.2g鐵粉投入40ml某HNO3溶液中,充分反應后剩余固體1.6g,產生NO2和NO的混合氣體0.08mol,若不考慮N2O4的存在,則原HNO3溶液的物質的量濃度( )
A.3.5 mol/L
B.4.5 mol/L
C.7.0 mol/L
D.9.0 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現將濃度相等、體積分別為V1、V2的H2SO4、NaOH溶液混合,測量混合液溫度,結果如圖(已知:V1+V2=60mL)。下列敘述錯誤的是 ( )

A. 實驗的環境溫度低于22℃ B. 混合溶液的導電能力:M>N
C. P點混合溶液呈中性 D. 若將H2SO4改為CH3COOH,P點溫度低于28℃
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com