

分析 (1)燃燒熱是指在25℃、101kPa下,1mol純凈物完全燃燒生成穩定的氧化物放出的熱量,表示燃燒熱的熱化學方程式中可燃物的物質的量必須為1mol,產物必須為穩定氧化物;
(2)原電池中負極失去電子,發生氧化反應;
(3)根據電解原理結合:出什么加什么,出多少加多少的原理來計算回答;
(4)燃料電池的負極上是燃料失電子的氧化反應,正極上是氧氣得電子的還原反應,根據電極反應式結合電子守恒來計算即可.
解答 解:(1)燃燒熱是在一定條件下,1mol可燃物完全燃燒生成穩定的氧化物時所放出的熱量,在25℃、101 kPa下,1 g甲烷完全燃燒后,恢復到原狀態放熱Q kJ,則1mol甲烷即16g甲烷完全燃燒后,恢復到原狀態放熱16Q kJ,因此表示甲烷燃燒熱的熱化學方程式為CH4 (g)+2O2(g)═CO2(g)+2H2O(l)△H=-16QkJ•mol-1.
故答案為:CH4 (g)+2O2(g)=CO2(g)+2H2O(l)△H=-16QkJ•mol-1;
(2)原電池中負極失去電子,發生氧化反應,肼(N2H4)一空氣燃料電池是一種堿性環保電池,該電池放電時,負極肼失去電子,電極反應式為N2H4+4OH--4e-=N2↑+4H2O,故答案為:N2H4+4OH--4e-=N2↑+4H2O;
(3)反應一段時間后,停止通電,向甲燒杯中滴入幾滴酚酞,觀察到石墨電極附近首先變紅,這說明石墨電極附近有氫氧根產生,因此該電極是氫離子放電,即該電極是陰極,則鐵是陽極,M是正極,N是負極,乙燒杯中銅電極是陰極,石墨電極是陽極,溶液中的氫氧根放電,所以乙燒杯中石墨電極附近pH值變小,通電一段時間后(溶液中還有CuSO4),由于電解產物是銅、氧氣和硫酸,則若要使乙燒杯中電解質溶液恢復到電解前的狀態,可加入氧化銅或碳酸銅,故選:AC;
(4)根據裝置圖可知a通入的是甲醇,該電極是負極,電極反應式為CH3OH-6e-+H2O=CO2↑+6H+,b通入的是氧氣,電極反應式為O2+4e-+4H+=2H2O,所以當電池中有1mol e-發生轉移時,左側消耗1/6mol水,右側產生0.5mol水,則左右兩側溶液的質量之差為$\frac{1}{6}$mol×18g/mol+0.5mol×18g/mol=12g,
故答案為:12g.
點評 本題考查燃燒熱的熱化學方程式的書寫、電解池和原電池的工作原理以及應用知識,題目難度不大,注意表示燃燒熱的熱化學方程式,可燃物為1mol,生成物為穩定的氧化物.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | HS-+H2O?H3O++S2- | B. | HS-+H2O?H2S+OH- | ||
| C. | HS-+H2O+=H2S↑+H2O | D. | CO32-+H2O+CO2=2HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
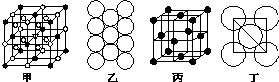 在電解冶煉鋁的過程中加入冰晶石,可起到降低Al2O3熔點的作用.冰晶石的生產原理為2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根據題意完成下列填空:
在電解冶煉鋁的過程中加入冰晶石,可起到降低Al2O3熔點的作用.冰晶石的生產原理為2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根據題意完成下列填空: .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
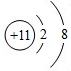
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素B的化合物可以用來做焰火材料 | |
| B. | 化合物AE與CE含有相同類型的化學鍵 | |
| C. | 工業上常用電解法制備元素C、D、E的單質 | |
| D. | 元素B、D的最高價氧化物對應的水化物之間可能發生反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
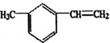 下列說法正確的是( )
下列說法正確的是( )| A. | 分子中所有碳原子可能處于同一平面上 | |
| B. | 分子中至少有7個碳原子一定處于同一平面上 | |
| C. | 分子中所有原子有可能處于同一平面上 | |
| D. | 分子中至多有16個原子處于同一平面上 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe3+、NH${\;}_{4}^{+}$、Br-、I- | B. | Fe2+、H+、NO3-、Cl- | ||
| C. | Fe3+、H+、SO42-、Br- | D. | Fe3+、Ca2+、NO3-、SO42-、 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
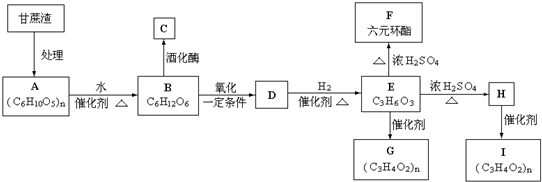
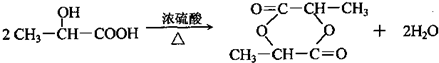


 上四 個碳原子各連接1個支鏈或取代基.
上四 個碳原子各連接1個支鏈或取代基.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com