
【題目】聯氨(N2H4)和次磷酸鈉(NaH2PO2)都具有強還原性.都有著廣泛的用途。
(1)已知:①N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-621.5 kJ●mol-1
②N2O4(l)-=N2(g)+2O2(g) △H2=+204.3 kJ●mol-1
則火箭燃料的燃燒反應為2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=_____.
(2)已知反應N2H4(g)+ 2Cl2(g)![]() N2(g)+4HCl(g),T°C時,向V L恒容密閉容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,測得Cl2和HCl的濃度隨時間的關系如圖所示。
N2(g)+4HCl(g),T°C時,向V L恒容密閉容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,測得Cl2和HCl的濃度隨時間的關系如圖所示。

①0~ 10 min內,用N2(g)表示的平均反應速率v(N2)=_______。
②M點時,N2H4的轉化率為______(精確到0.1)%。
③T °C時,達到平衡后再向該容器中加入1.2 mol N2H4(g)、0.4 mol Cl2(g)、0. 8 mol N2 (g)、1.2 mol HCl(g) ,此時平衡______(填“正向移動”“逆向移動”或“不移動”)。
(3)①在惰性氣體中,將黃磷(P4)與石灰乳和碳酸鈉溶液一同加入高速乳化反應器中制得NaH2PO2,同時還產生磷化氫(PH3)氣體,該反應的化學方程式為________________。
②次磷酸(H3PO2)是一元酸,常溫下.1.0 mol●L-1的NaH2PO2溶液pH為8,則次磷酸的Ka=___________。
③用次磷酸鈉通過電滲析法制備次磷酸.裝置如圖2所示。交換膜A屬于____(填“陽離子”或“陰離子”)交換膜,電極N的電極反應式為______,當電路中流過3.8528×105庫侖電量時.制得次磷酸的物質的量為_____ (一個電子的電量為 1.6×10- 19庫侖,NA數值約為6. 02× 1023)。

【答案】-1038.7kJmol-1 0.06mol/(Lmin) 33.3 逆向移動 2P4+3Ca(OH)2+3Na2CO3+6H2O==== 6NaH2PO2+2PH3↑+3CaCO3 1.0×10-2 陽離子 2H2O+2e-=H2↑+2OH- 4mol
【解析】
(1)根據蓋斯定律,反應①×2+②即可得火箭燃料的燃燒反應2N2H4(1)+N2O4(l)===3N2(g)+4H2O(g)△H=(-621.5×2+204.3)kJmol-1=-1038.7kJmol-1;
(2)根據圖示,Cl2作為反應物濃度需減小,HCl作為生成物濃度需增大,
①△c(Cl2)=(2-0.8)mol/L=1.2mol/L,v(Cl2)=![]() =0.12mol/(Lmin),根據反應速率與計量系數成正比可得v(N2)=
=0.12mol/(Lmin),根據反應速率與計量系數成正比可得v(N2)=![]() v(Cl2)=0.06mol/(Lmin),
v(Cl2)=0.06mol/(Lmin),
②據圖可知反應開始時c(Cl2)=2mol/L,投料為2 mol N2H4(g)和4 mol Cl2(g) ,則開始時c(N2H4)=1mol/L,容器體積為2L,設M點 N2H4的轉化量為x mol/L,列三段式:
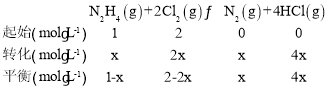
M點Cl2和HCl的濃度相等,則2-2x=4x解得x=![]() mol/L,則N2H4的轉化率為
mol/L,則N2H4的轉化率為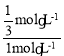 =33.3%;
=33.3%;
③據圖可知反應平衡時c(Cl2)=0.8mol/L,初始c(Cl2)=2mol/L,c(N2H4)=1mol/L,則根據反應方程式N2H4(g)+ 2Cl2(g)![]() N2(g)+4HCl(g)可知,反應中消耗c(Cl2)=1.2mol/L,消耗c(N2H4)=0.6mol/L,生成c(N2)=0.6mol/L,c(HCl)=2.4mol/L,所以平衡時各物質的濃度為c(Cl2)=0.8mol/L,c(N2H4)=0.4mol/L,c(N2)=0.6mol/L,c(HCl)=2.4mol/L,則該溫度下的平衡常數K=
N2(g)+4HCl(g)可知,反應中消耗c(Cl2)=1.2mol/L,消耗c(N2H4)=0.6mol/L,生成c(N2)=0.6mol/L,c(HCl)=2.4mol/L,所以平衡時各物質的濃度為c(Cl2)=0.8mol/L,c(N2H4)=0.4mol/L,c(N2)=0.6mol/L,c(HCl)=2.4mol/L,則該溫度下的平衡常數K=![]() =77.76;
=77.76;
平衡后再向該容器中加入1.2molN2H4(g)、0.4 mol Cl2(g)、0.8molN2(g)、1.2molHCl(g),各物質的濃度變為c(Cl2)=1mol/L,c(N2H4)=1mol/L,c(N2)=1mol/L,c(HCl)=3mol/L,此時Qc=![]() =81>K,所以平衡逆向移動;
=81>K,所以平衡逆向移動;
(3)①該反應中反應物有P4、Ca(OH)2、Na2CO3等、生成物有NaH2PO2、PH3等,據此可知該反應中P元素化合價既升高又降低,發生歧化,升高1價,降低3價,則NaH2PO2和PH3的系數比為3:1,再結合元素守恒可知方程式為:2P4+3Ca(OH)2+3Na2CO3+6H2O==== 6NaH2PO2+2PH3↑+3CaCO3;
②次磷酸(H3PO2)是一元酸,1.0molL-1的 NaH2PO2溶液水解方程式為:H2PO2-+H2O=H3PO2![]() =1.0×10-2;
=1.0×10-2;
③根據圖示可知,產品室產生次磷酸,則電極M應為陽極電解水中的OH-,剩余H+通過交換膜A移向產品室,所以交換膜A為陽離子交換膜;電極N為陰極電解H+,電極N的電極反應式為2H2O+2e-=H2↑+2OH-;電路中流過3.8528×105庫侖電量時,轉移的電子的物質的量為![]() =4mol,次磷酸根帶一個負電荷,氫離子帶一個正電荷,所以電解過程中轉移1mol電子生成1mol次磷酸,則轉移4mol電子時生成4mol次磷酸。
=4mol,次磷酸根帶一個負電荷,氫離子帶一個正電荷,所以電解過程中轉移1mol電子生成1mol次磷酸,則轉移4mol電子時生成4mol次磷酸。


 寒假學與練系列答案
寒假學與練系列答案科目:高中化學 來源: 題型:
【題目】鎂及其化合物一般無毒(或低毒)、無污染,且鎂原電池放電時電壓高而平穩,使鎂原電池越來越成為人們研制綠色原電池的關注焦點。其中一種鎂原電池的反應為xMg+Mo3S4![]() MgxMo3S4,下列說法正確的是( )
MgxMo3S4,下列說法正確的是( )
A.電池充電時,陰極發生還原反應生成Mo3S4
B.電池充電時,陽極反應為xMg-2xe-===xMg2+
C.電池放電時,Mg2+向負極遷移
D.電池放電時,正極反應為Mo3S4+2xe-+xMg2+=== MgxMo3S4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列說法正確的是( )
A. 標準狀況下,22.4 L氫氣中含有2NA個中子
B. 0.1NA個氯化氫分子占有體積為2.24 L
C. 2克金屬鈣變成鈣離子時失去的電子數為0.1NA
D. 50 mL 0.1 mol·L-1H2SO4溶液中含有H+數為0.005NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從古至今,鐵及其化合物在人類的生產生活中都起了巨大的作用。
(1)古代中國四大發明之一的指南針是由天然磁石制成的,其主要成分是_________________。
A.Fe B.FeO C.Fe3O4 D.Fe2O3
(2)在現代化工生產中,常利用FeCl3腐蝕銅的原理制作印刷線路板,寫出該原理的化學方程式_________________________________。
(3)實驗室用綠礬FeSO4·xH2O配制FeSO4溶液時為了防止FeSO4溶液變質,經常向其中加入鐵粉,其原因是_____________________ (用離子方程式表示)。
(4)某同學甲取2 mL FeSO4溶液,加入1滴KSCN溶液,再加入幾滴氯水,溶液變紅,說明Cl2可將Fe2+氧化。綠礬溶液與氯水反應的離子方程式為_______。
(5)同學乙認為甲同學的實驗不夠嚴謹,該同學在2 mL FeSO4 溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和幾滴氯水,溶液變紅,煤油的作用是_____________。
(6)為測定某綠礬FeSO4·xH2O中結晶水含量,將石英玻璃管(帶兩端開關K1和K2)(設為裝置A)稱重,記為m1 g;將樣品裝入石英玻璃管中,再次將裝置A稱重,記為 m2 g;按下圖連接好裝置進行實驗:

①儀器B的名稱是____________。
②將下列實驗操作步驟正確排序__________(填標號);重復上述操作步驟,直至A恒重,記為m3 g。
a.點燃酒精燈,加熱
b.熄滅酒精燈
c.關閉K1和K2
d.打開K1和K2,緩緩通入N2
e.稱量A
f.冷卻至室溫
③根據實驗記錄,計算綠礬FeSO4·xH2O化學式中結晶水數目x=_______________________(列式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】家用液化氣的主要成分之一是丁烷,當10kg丁烷完全燃燒并生成二氧化碳和液態水時,放出熱量為5×105kJ,試寫出丁烷燃燒的熱化學方程式____________________,已知1mol液態水氣化時需要吸收44kJ的熱量,則反應![]() 的ΔH為____________________。
的ΔH為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用活性炭還原法處理氮氧化物,有關反應為:C(s)+ 2NO(g)![]() N2(g)+ CO2(g)。某研究小組向某密閉的真空容器(假設容器體積不變,固體試樣體積忽略不計)中加入NO和足量的活性炭,恒溫(T1℃)條件下反應,反應進行到不同時間測得各物質的濃度如下:
N2(g)+ CO2(g)。某研究小組向某密閉的真空容器(假設容器體積不變,固體試樣體積忽略不計)中加入NO和足量的活性炭,恒溫(T1℃)條件下反應,反應進行到不同時間測得各物質的濃度如下:
時間min/ 濃度mol·L-1 | NO | N2 | CO2 |
0 | 1.00 | 0 | 0 |
10 | 0.58 | 0.21 | 0.21 |
20 | 0.40 | 0.30 | 0.30 |
30 | 0.40 | 0.30 | 0.30 |
40 | 0.32 | 0.34 | 0.17 |
50 | 0.32 | 0.34 | 0.17 |
(1) 10 min~20 min的時間段內,以CO2表示的反應速率為____;
(2)計算出該反應的平衡常數的值K=________;
(3) 下列各項能作為判斷該反應達到平衡狀態的是____ (填序號字母);
A.容器內壓強保持不變 B.2v正(NO)= v逆(N2)
C.容器內CO2的體積分數不變 D.混合氣體的密度保持不變
(4)30 min時改變某一條件,反應重新達到平衡,則改變的條件可能是_____________;
(5)一定溫度下,隨著NO的起始濃度增大,則NO的平衡轉化率__________ (填“增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.NaNO2 因外觀和食鹽相似,又有咸味,容易使人誤食中毒。已知 NaNO2能發生反應:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反應中氧化劑是 ________。(填化學式)
(2)根據上述反應,鑒別 NaNO2 和 NaCl。可選用的物質有 ①水、②碘化鉀淀粉試紙③淀粉、④白酒、⑤食醋,你認為必須選用的物質有________(填序號)。
(3)請配平以下化學方程式:____Al+____NaNO3+____ NaOH= ____NaAlO2+____ N2↑+___H2O
若反應過程中轉移 5 mol 電子,則生成標準狀況下 N2 的體積為_________L。
Ⅱ.“鋼是虎,釩是翼,鋼含釩猶如虎添翼”,釩是“現代工業的味精”。釩對稀酸是穩定的,但室溫下能溶解于濃硝酸中生成 VO2+。
(4)V2O5 是兩性氧化物,與強堿反應生成釩酸鹽(陰離子為 VO43-),溶于強酸生成含釩氧離子(VO2+)的鹽。請寫出 V2O5 分別與燒堿溶液和稀硫酸反應生成的鹽的化學式:_______、_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】草酸(H2C2O4)是一種二元弱酸,廣泛分布于動植物體中。
(1)人體內草酸累積過多是導致結石(主要成分是草酸鈣)形成的原因之一。有研究發現,EDTA(一種能結合金屬離子的試劑)在一定條件下可以有效溶解結石,用化學平衡原理解釋其原因:_______________。
(2)已知:0.1 mol·L-1KHC2O4溶液呈酸性。下列說法正確的是_______(填字母序號)。
a. 0.1 mol·L-1KHC2O4溶液中:c(K+) + c(H+) = c(HC2O4-) + 2c(C2O42-) + c(OH-)
b. 0.1 mol·L-1KHC2O4溶液中:c(K+) > c(HC2O4-) > c(C2O42-) > c(H2C2O4)
c. 濃度均為0.1 mol·L-1KHC2O4和K2C2O4的混合溶液中:2c(K+) = c(HC2O4-) + c(C2O42-)
d. 0.1 mol/L KHC2O4溶液中滴加等濃度NaOH溶液至中性:c(K+) > c(Na+)
(3)利用草酸制備草酸亞鐵晶體(FeC2O4·xH2O)的流程及組分測定方法如下:
![]()
已知:i. pH>4時,Fe2+易被氧氣氧化
ii. 幾種物質的溶解度(g /100g H2O)如下
FeSO4·7H2O | (NH4)2SO4 | FeSO4·(NH4)2SO4·6H2O | |
20℃ | 48 | 75 | 37 |
60℃ | 101 | 88 | 38 |
①用稀硫酸調溶液pH至1~2的目的是:_____________,______________。
②趁熱過濾的原因是:_______________。
③氧化還原滴定法常用于測定草酸亞鐵晶體的摩爾質量(M)。稱取a g草酸亞鐵晶體溶于稀硫酸中,用b mol·L-1的高錳酸鉀標準液滴定,到達滴定終點時,消耗高錳酸鉀VmL,則M =__________。(已知:部分反應產物為Mn2+、Fe3+、CO2)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知298K時,Ksp(MnS)=4.65×1014,Ksp(MnCO3)=2.24×1011,298K下,MnS、MnCO3(R2代表S2或CO32-)在水中的溶解曲線如圖所示,下列說法正確的是
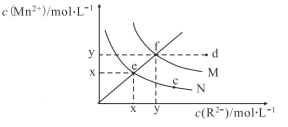
A.圖象中x約等于2.2×107
B.其它條件不變,加熱N的懸濁液可使溶液組成由e點沿ef線向f點方向移動
C.常溫下,加水稀釋M溶液可使溶液組成由d點沿df線向f點方向移動
D.向含有MnS和MnCO3的飽和溶液中加少量MnCl2,![]() 增大
增大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com