
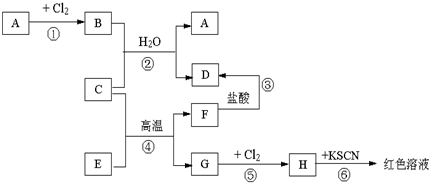
分析 A、C、G是金屬,G和氯氣反應生成H,H和KSCN反應后溶液呈紅色,說明H是FeCl3,所以G是Fe,C是金屬單質、E和F是氧化物,G是Fe單質,結合反應條件知④發生鋁熱反應,則C是Al,F是Al2O3,E是Fe2O3,
A是金屬單質,和氯氣反應生成氯化物,B溶于水得藍色溶液,說明B中含有銅離子,根據元素守恒知,B為CuCl2,Al和CuCl2發生置換反應生成Cu和AlCl3,D是AlCl3,氧化鋁和鹽酸反應生成氯化鋁,結合物質的性質分析解答.
解答 解:(1)通過以上分析知,A、D、H分別是:Cu、AlCl3、FeCl3,故答案為:Cu;AlCl3;FeCl3;
(2)鋁和氧化鐵發生鋁熱反應生成氧化鋁和鐵,反應方程式為:2Al+Fe2O3$\frac{\underline{\;高溫\;}}{\;}$Al2O3+2Fe,
故答案為:2Al+Fe2O3$\frac{\underline{\;高溫\;}}{\;}$Al2O3+2Fe;
(3)①由金屬元素在周期表中的位置可知Al的金屬性比Ba弱,故答案為:弱;
②但Al在高溫下可將氧化鋇中鋇置換出來,原因是Ba的沸點低于鋁,高溫時Ba轉化為氣體脫離反應體系,使反應正向進行,故答案為:d;
(4)氯化鐵具有氧化性,碘化氫具有還原性,二者發生氧化還原反應生成氯化亞鐵和碘單質,反應離子方程式為:2Fe3++2I-=2Fe2++I2,
故答案為:2Fe3++2I-=2Fe2++I2;
(5)n(Cu)=$\frac{51.2g}{64g/mol}$=0.8mol,Cu和硝酸恰好完全反應生成NO2、NO,生成物還有Cu(NO3)2,根據N原子守恒得n(HNO3)=2n[Cu(NO3)2]+n(NOx)=2×0.8mol+$\frac{31.36L}{22.4L/mol}$=3mol,c(HNO3)=$\frac{n}{V}$=$\frac{3mol}{0.2L}$=15mol/L,
故答案為:15.
點評 本題以鋁、鐵為載體考查了無機物的推斷,明確物質的性質及物質的特殊反應現象是解本題關鍵,根據⑥為突破口采用正逆結合的方法進行推斷,結合基本概念、物質間的反應分析解答,鐵離子的檢驗是高考熱點,會運用化學語言描述實驗現象,根據現象得出結論,題目難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2、H2S | B. | NH3、CO2 | C. | Cl2、CO2 | D. | SO2、Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氧燃料電池在酸性介質中的正極反應式:O2+4H++4e-═2H2O | |
| B. | 用鐵棒作陽極、碳棒作陰極電解飽和氯化鈉溶液的離子方程式為:2C1-+2H2O$\frac{\underline{\;電解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 粗銅精煉時,與電源正極相連的是純銅,電極反應式為:Cu一2e-=Cu2+ | |
| D. | 反應HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H<0,在理論上能用于設計原電池 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2 (g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 | |
| B. | 2H2(g)+O2 (g)═2H2O(g);△H1 2H2 (g)+O2 (g)═2H2O(l);△H2 | |
| C. | CO(g)+$\frac{1}{2}$ O2(g)═CO2(g);△H1 2CO(g)+O2(g)═2CO2(g);△H2 | |
| D. | S(s)+O2(g)═SO2 (g);△H1 S(g)+O2(g)═SO2 (g);△H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t/min | 0 | 1 | 3 | 5 |
| n(CO)/mol | 10 | 7 | 5 | 5 |
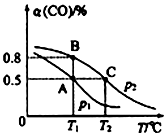
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 化合物AX3和單質X2在一定條件下反應可生成化合物AX5.回答下列問題.
化合物AX3和單質X2在一定條件下反應可生成化合物AX5.回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
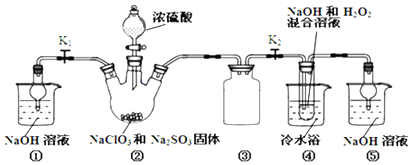
| 實驗序號 | 滴定前讀數/mL | 滴定后讀數/mL |
| 1 | 0.00 | 19.96 |
| 2 | 3.26 | 23.30 |
| 3 | 1.10 | 23.40 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 一定溫度下,將1mol A和1mol B氣體充入2L密閉容器,發生反應A(g)+B(g)?xC(g)+D(s),t1時達到平衡.在t2、t3時刻分別改變反應的一個條件,測得容器中氣體C的濃度隨時間變化如圖所示.下列說法正確是( )
一定溫度下,將1mol A和1mol B氣體充入2L密閉容器,發生反應A(g)+B(g)?xC(g)+D(s),t1時達到平衡.在t2、t3時刻分別改變反應的一個條件,測得容器中氣體C的濃度隨時間變化如圖所示.下列說法正確是( )| A. | 該反應方程式中的x=l | |
| B. | 0~t1時,用A表示的反應速率υ(A)=0.50mol/(L•min) | |
| C. | t2和t3時,改變的條件分別是加入催化劑和移去少量物質D | |
| D. | t1~t3間,該反應的平衡常數均為4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com