
【題目】氫鍵是介于范德華力和化學鍵之間的一種作用力,廣泛存在于許多物質中.氫鍵的通式可表示為X﹣H…Y,其中X、Y均是非金屬性較強、半徑較小的原子,如F、O、N等;X、Y可以是同種原子也可以是不同種原子.
(1)用氫鍵的通式分別表示:冰中H2O分子間的氫鍵 , 氨水中H2O分子與NH3分子之間的氫鍵 .
(2)已知水中2個水分子之間可以發生微弱的自偶電離,電離方程式為:2H2OH3O++OH﹣ . 實驗測得在液氨中2個NH3分子之間也可以微弱地電離生成含有相同電子數的離子,其電離方程式是: , 寫出這兩種離子的電子式、 .
【答案】
(1)O﹣H…O;O﹣H…N,N﹣H…O
(2)NH3+NH3?NH4++NH2﹣;![]() ;
;![]()
【解析】解:(1)冰中一個水分子的O原子與另一個水分子中的H原子形成氫鍵,即表示為O﹣H…O;氨水中H2O中O原子與NH3分子中的H原子形成氫鍵,即N﹣H…O,H2O中H原子與NH3分子中的N原子也形成氫鍵,即O﹣H…N;所以答案是:O﹣H…N;O﹣H…N,N﹣H…O;(2)水電離生成H3O+和OH﹣叫做水的自偶電離.同水一樣,液氨也有自偶電離,其自偶電離的方程式為:NH3+NH3NH4++NH2﹣;NH4+是多原子構成的陽離子,電子式要加中括號和電荷,其電子式為: ![]() ;NH2﹣為多原子構成的陰離子,電子式要加中括號和電荷,其電子式為:
;NH2﹣為多原子構成的陰離子,電子式要加中括號和電荷,其電子式為: ![]() .所以答案是:NH3+NH3NH4++NH2﹣;
.所以答案是:NH3+NH3NH4++NH2﹣; ![]() ;
; ![]() .
.
【考點精析】利用弱電解質在水溶液中的電離平衡對題目進行判斷即可得到答案,需要熟知當弱電解質分子離解成離子的速率等于結合成分子的速率時,弱電解質的電離就處于電離平衡狀態;電離平衡是化學平衡的一種,同樣具有化學平衡的特征.條件改變時平衡移動的規律符合勒沙特列原理.


科目:高中化學 來源: 題型:
【題目】已知:2CO(g)+O2(g)═2CO2(g)△H=﹣566kJmol﹣1
N2(g)+O2(g)═2NO(g)△H=+180kJmol﹣1
則2CO(g)+2NO(g)═N2(g)+2CO2(g)的△H是( )
A.﹣386 kJmol﹣1
B.+386 kJmol﹣1
C.﹣746 kJmol﹣1
D.+746 kJmol﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種有機玻璃的結構簡式為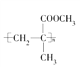 。下列關于它的敘述中不正確的是( )
。下列關于它的敘述中不正確的是( )
A. ![]() 在一定條件下發生縮聚反應即可合成該有機玻璃
在一定條件下發生縮聚反應即可合成該有機玻璃
B. 該有機玻璃能發生氧化反應
C. 合成該有機玻璃的原料可能有甲烷
D. 它在一定條件下發生水解反應時C—O鍵斷裂
查看答案和解析>>
科目:高中化學 來源: 題型:
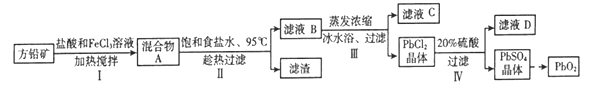
【題目】鉛蓄電池有廣泛的應用,由方鉛礦(PbS)制備鉛蓄電池電極材料(PbO2)的方法如下:
査閱資料:①PbCl2(s)+2Cl-(aq) ![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
②Fe3+、Pb2+以氫氧化物形式開始沉淀時的PH值分別為1.9、7.0
③不同溫度和濃度的食鹽溶液中PbCl2的溶解度(g L-1):
| 20 | 40 | 60 | 100 | 180 | 260 | 300 |
13 | 3 | 1 | 0 | 0 | 3 | 9 | 13 |
50 | 8 | 4 | 3 | 5 | 10 | 21 | 35 |
100 | 17 | 11 | 12 | 15 | 30 | 65 | 95 |
(1)步驟I中FeCl3溶液與PbS反應生成PbCl2和S的化學方程式為__________________;
加入鹽酸控制pH小于1.0的原因是________。
(2)步驟II中浸泡溶解時采用95℃和飽和食鹽水的目的分別是____________、_____________。
(3)步驟III中將濾液B蒸發濃縮后再用冰水浴的原因是___________(請用平衡移動原理解釋)。
(4)驟IV需用溶質質量分數為20%、密度為1.22 g·cm-3的硫酸溶液,現用溶質質量分數為98.3%、密度為1.84 g·cm-3的濃硫酸配制,需用到的玻璃儀器有___________ (填相應的字母)。
A.燒杯 B.量筒 C.容量瓶 D.錐形瓶 E.玻璃棒 F.膠頭滴管
(5)用鉛蓄電池為電源,采用電解法分開處理含有Cr2O72-及含有NO2-的酸性廢水(最終Cr2O72-轉化為Cr(OH)3, NO2-轉化為無毒物質),其裝置如下圖所示。
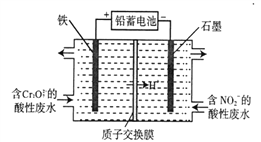
①左池中Cr2O72-轉化為Cr3+的離子方程式是__________________。
②當陰極區消耗2 mol NO2-時,右池減少的H+的物質的量為______________ mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有部分短周期元素的性質或原子結構如表:
元素編號 | 元素性質或原子結構 |
A | 有三個電子層,K,M層電子數之和等于L層電子數 |
B | 短周期中金屬性最強 |
C | 常溫下單質為雙原子分子,氫化物的水溶液呈堿性 |
D | 元素最高正價是+7價 |
(1)用化學用語回答下列問題:
①A元素在周期表中的位置;
②C單質分子的電子式;
③D的原子結構示意圖;
④電子式表示A和B元素組成的化合物的形成過程: .
(2)元素D與元素A相比,非金屬性較強的是(用元素符號表示),下列表述中能證明這一事實的是(填選項序號).
a.常溫下D的單質和A的單質狀態不同
b.D的氫化物比A的氫化物穩定
c.一定條件下D和A的單質都能與鈉反應
d.A最高價含氧酸的酸性弱于D最高價含氧酸
e.D單質能與A的氫化物反應生成A單質
(3)X是由A,B,C,D四種元素中的某種元素組成的單質,能經圖所示的過程轉化為(其他條件略去). ![]()
①若Y是有刺激性氣味的無色氣體,把Y通入BaCl2溶液中,無現象,然后滴加適量H2O2溶液,有白色沉淀生成,則該白色沉淀為 , 試寫出Y與H2O2溶液反應的化學方程式:;
②若Z是紅棕色氣體,則Z→W的反應中氧化劑與還原劑物質的量之比為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組設計了一組實驗來探究元素周期律.
甲同學根據元素非金屬性與對應最高價含氧酸之間的關系,設計了如圖1裝置來一次性完成同主族元素C和Si的非金屬性強弱比較的實驗研究;乙同學設計了如圖2裝置來驗證鹵族元素的性質遞變規律,
圖2中A,B,C三處分別是沾有NaBr溶液的棉花、濕潤的淀粉KI試紙、濕潤的紅紙.(已知常溫下濃鹽酸與高錳酸鉀能反應生成氯氣).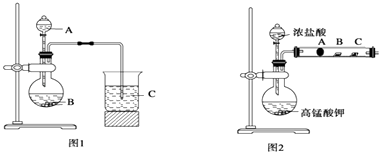
(1)甲同學設計的實驗,固體B為大理石,試劑A為(填序號);
①稀硝酸 ②濃鹽酸 ③NaOH溶液 ④Na2SiO3溶液
(2)寫出圖1燒瓶中發生反應的離子方程式;
(3)甲同學所做實驗圖1燒杯中現象為;
(4)乙同學所做實驗圖2中B處的現象為;
(5)寫出圖2中A處發生反應的離子方程式;
(6)乙同學用圖2來完成實驗驗證鹵素單質氧化性:Cl2>Br2>I2 , 你認為合理嗎?(填“合理”或“不合理”)理由是 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com