
【題目】某物質只含C、H、O三種元素,其分子模型如圖所示,分子中共有12個原子(圖中球與球之間的連線代表單鍵、雙鍵等化學鍵).
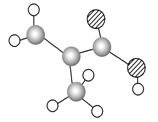
(1)該物質的結構簡式為________________.
(2)該物質中所含官能團的名稱為______________.
(3)下列物質中,與該產品互為同系物的是(填序號)__________,互為同分異構體的是____________.
①CH3CH===CHCOOH ②CH2===CHCOOCH3 ③CH3CH2CH===CHCOOH
④CH3CH(CH3)COOH ⑤CH2===CHCOOH
(4)該物質在一定條件下發生加聚反應的化學方程式為__________________________.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】 Ⅰ.按己知的原子結構規律,82號元素X應是第_________周期_________族元素,它的最高正價氧化物的化學式為_________。
Ⅱ.下列變化中:①干冰氣化;②硝酸鉀熔化;③KHSO4熔融;④硫酸溶于水;⑤蔗糖溶于水;⑥HI分解。用序號填空:
(1)未破壞化學鍵的是_____________。
(2)僅離子鍵被破壞的是_____________。
(3)僅共價鍵被破壞的是_____________。
Ⅲ.有下列各組物質:①石墨和足球烯C60;②126C和136C;③CH3—CH2—CH2—CH3和CH3—CH(CH3)CH3;④漂白粉和漂白液主要成分;⑤正丁烷和異庚烷;⑥乙烯和聚乙烯;⑦![]() 和
和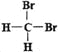 ;⑧丙烷和環丙烷。用序號填空:
;⑧丙烷和環丙烷。用序號填空:
(1)__________組兩者互為同位素。(2)__________組兩者互為同素異形體。
(3)__________組兩者屬于同系物。(4)__________組兩者互為同分異構體。
(5)__________組兩者是同一物質。
查看答案和解析>>
科目:高中化學 來源: 題型:
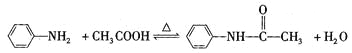
【題目】乙酰苯胺是一種白色有光澤片狀結晶或白色結晶粉末,是磺胺類藥物的原料,可用作止痛劑、退熱劑和防腐劑、乙酰苯胺的制備原理為
實驗參數
名稱 | 相對分 | 性狀 | 密度(g/mL) | 沸點( | 溶解性 | |
苯胺 | 93 | 無色油狀液體 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
乙酸 | 60 | 無色液體 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰 | 135 | 白色晶體 | 1.22 | 304 | 微溶于冷水,可溶于熱水 | 易溶于乙醇、乙醚 |
實驗裝置如圖所示(部分儀器及夾持裝置已略去)。
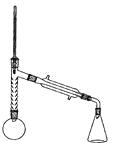
注:①刺型分餾柱的作用相當于二次蒸餾,用于沸點差別不太大的混合物的分離。②苯胺易被氧化。
實驗步驟:
步驟1:在100mL圓底燒瓶中加入無水苯胺9.3mL、冰醋酸18.4mL、鋅粉0.1g和少量沸石,安裝好儀器后,對圓底燒瓶均勻加熱,使反應液在微沸狀態下回流,調節加熱溫度,使溫度計溫度控制在105![]() 左右;反應約60~80min,反應生成的水及少量醋酸被蒸出,當反應基本完成時,停止加熱。
左右;反應約60~80min,反應生成的水及少量醋酸被蒸出,當反應基本完成時,停止加熱。
步驟2:在攪拌下,趁熱將蒸餾燒瓶中的液體以細流狀倒入盛有冰水的100mL燒杯中,快速攪拌,乙酰苯胺結晶析出,燒杯內試劑冷卻至室溫后,進行抽濾、洗滌、干燥,可得到乙酰苯胺粗品。
步驟3:將乙酰苯胺粗品進行重結晶,待結晶完全后抽濾,盡量壓甘干濾餅。將產品置于干凈的表面皿中晾干,稱重,計算產率、
請回答下列問題:
(1)實驗中加入鋅粉的目的是_____________________。
(2)從化學平衡的角度分析,控制溫度計的溫度在105![]() 左右的原因是______________。
左右的原因是______________。
(3)通過_____________可判斷反應基本完成、
(4)步驟1加熱可用_____________(填“水浴”或“油浴”)。
(5)洗滌乙酰苯胺粗品最合適的方法是__________________(填字母)。
A.用少量冷水洗
B.用少量熱水洗
C.先用冷水洗,再用熱水洗
D.用酒精洗
(6)步驟2得到的粗品中因含有某些雜質而顏色較深,步驟3重結晶的操作是:將粗品用熱水溶解,加入活性炭0.1g,煮沸進行脫色,______________,再將濾液冷卻結晶。
(7)該實驗最終得到產品9.1g,則乙酰苯胺的產率是____________(小數點后保留兩位數字。)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應Fe+H2SO4===FeSO4+H2↑的能量變化趨勢,如圖所示:
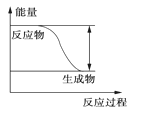
(1)該反應為________反應(填“吸熱”或“放熱”)。
(2)若要使該反應的反應速率加快,下列措施可行的是_____(填字母)。
A.改鐵片為鐵粉 B.增大壓強
C.升高溫度 D.改稀硫酸為98%的濃硫酸
(3)若將上述反應設計成原電池,銅為原電池某一極材料,則銅為______極(填“正”或“負”)。銅片上產生的現象為________________;該極上發生的電極反應為______________;外電路中電子由 _______極向_______極移動。(填“正”或“負”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有反應:mA(g)+nB(g) ![]() pC(g),達到平衡后,當升高溫度時,B的轉化率變大;當減小壓強時,混合體系中C的質量分數減小,則:
pC(g),達到平衡后,當升高溫度時,B的轉化率變大;當減小壓強時,混合體系中C的質量分數減小,則:
(1)該反應的逆反應為________熱反應,且m+n______p (填“>”、“=”或“<”) 。
(2)減壓時,A的質量分數__________。(填“增大”、“減小”或“不變”,下同)
(3)若容積不變加入B,則B的轉化率__________。
(4)若升高溫度,則平衡時B、C的濃度之比將__________。
(5)若加入催化劑,平衡時氣體混合物的總物質的量__________。
(6)若B是有色物質,A、C均無色,則加入C(體積不變)時混合物顏色__________;而維持容器內壓強不變,充入氖氣時,混合物顏色 。(填“變深”、“變淺”或“不變”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高錳酸鉀是中學化學常用的試劑。工業上用軟錳礦制備高錳酸鉀流程如下:
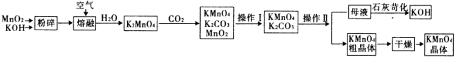
(1)鉍酸鈉(NaBiO3,不溶于水)用于定性檢驗酸性溶液中Mn2+的存在(鉍的還原產物為Bi3+),Mn2+的氧化產物為MnO4-,寫出反應的離子方程式_________________________________________。
(2)KMnO4稀溶液是一種常用的消毒劑。其消毒原理與下列物質相同的是_____(填代號)。
a.84消毒液(NaClO溶液) b.雙氧水 c.苯酚 d.75%酒精
(3)上述流程中可以循環使用的物質有氫氧化鉀和_______(寫化學式)。
(4)理論上(若不考慮物質循環與制備過程中的損失)1 mol MnO2可制得_____mol KMnO4。
(5)該生產中需要純凈的CO2氣體。寫出實驗室制取CO2的化學方程式___________________,所需氣體發生裝置可以是______(選填代號)。
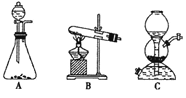
(6)操作Ⅰ的名稱是________;操作Ⅱ根據 KMnO4和K2CO3兩物質在______(填性質)上的差異,
采用__________(填操作步驟)、趁熱過濾得到 KMnO4。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫-氨熱化學循環制氫示意圖如下:
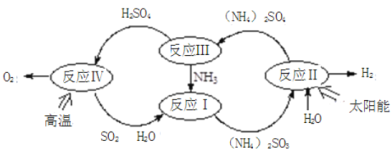
(1)反應Ⅱ是將太陽能轉化為電能,再轉化為化學能,電解池陽極的電極反應式 _______________;
(2)反應Ⅲ中控制反應條件很重要,不同條件下硫酸銨分解產物不同。連接裝置A-B-C,檢查氣密性,按圖示重新加入試劑。通入N2排盡空氣后,于400℃加熱裝置A 至(NH4)2SO4完全分解無殘留物,停止加熱,冷卻,停止通入N2。觀察到裝置A、B之間的導氣管內有少量白色固體。經檢驗,該白色固體和裝置B內溶液中有SO32-,無SO42-。進一步研究發現,氣體產物中無氮氧化物。
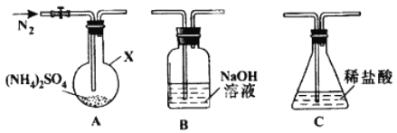
(NH4)2 SO4在400℃分解的化學方程式是:________________________________________;
(3)反應Ⅳ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O (l) △H=+462kJ/mol
它由兩步反應組成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177kJ/mol
ii.SO3(g)分解。
iii.H2O(l)=H2O(g) △H=+44kJ/mol
①L(L1、L2),X可分別代表壓強或溫度。下圖表示 L一定時,ii中SO3(g)的平衡轉化率隨X的變化關系。
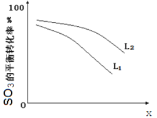
i.X代表的物理量是:________________,
ii.判斷L1、L2的大小關系,并簡述理由:________________________________________;
②反SO3分解的熱化學方程式為:__________________________________________________;
(4)恒溫密閉容器中,控制不同溫度進行SO3分解實驗。SO3起始濃度均為 cmol·L-1,測定SO3的轉化率,結果如圖,圖中Ⅰ曲線為SO3的平衡轉化率與溫度的關系,Ⅱ曲線表示不同溫度下反應經過相同反應時間且未達到化學平衡時SO3的轉化率。
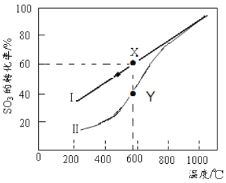
①圖中點X點平衡常數:K=_____ ;
②Y點對應溫度下的反應速率:v(正)______v(逆)(選填:>,<,=);隨溫度的升高,Ⅱ曲線逼近Ⅰ曲線的原因是:_____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用右圖所示的裝置制取乙酸乙酯。回答下列問題:
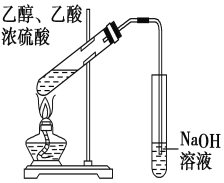
(1)寫出制取乙酸乙酯的化學反應方程式 。
(2)濃硫酸的作用是: 。
(3)實驗裝置圖有明顯錯誤,請指出錯誤是 。
(4)實驗中可以觀察到的現象是________________________ _____________ 。
(5) 寫出把制得的乙酸乙酯分離出來所需的試劑和方法 。
(6)生成乙酸乙酯的反應是可逆反應,反應物不能完全變成生成物,反應一段時間后,
就達到了該反應的限度,也即達到化學平衡狀態。下列描述能說明乙醇與乙酸的酯化反應已達到化學平衡狀態的有(填序號) 。
①單位時間里,生成1mol乙酸乙酯,同時生成1mol乙酸
②單位時間里,生成1mol乙酸乙酯,同時生成1mol水
③單位時間里,消耗1mol乙醇,同時消耗1mol乙酸
④混合物中各物質的濃度不再變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來,乳酸[CH3CH(OH)COOH]成為人們的研究熱點之一。乳酸可以用化學方法合成,也可以由淀粉通過生物發酵法制備。請完成下列有關問題:
(1)寫出乳酸分子中所有官能團的名稱_____________。
(2)在一定條件下,下列物質不能與乳酸發生反應的是________。
A.溴水 B.NaOH溶液 C.Cu(OH)2懸濁液 D.C2H5OH
(3)如果以丙烯(CH2=CH—CH3)為主要原料(其他無機原料任選)合成乳酸,其合成過程的流程圖如下:
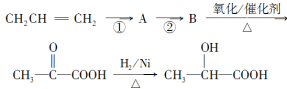
則①的反應類型是________;反應②的化學方程式為____________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com