
 實驗室制備溴苯可用如圖所示裝置.填空:
實驗室制備溴苯可用如圖所示裝置.填空: .
.分析 實驗室制備溴苯是用苯和液溴在鐵粉作催化劑的條件下發生取代反應生成溴苯和溴化氫,根據裝置圖可知,生成溴苯的同進還有溴化氫生成另外還有少部分溴揮發,所以在D裝置中石蕊會變紅,E中的硝酸銀會產生溴化銀沉淀,尾氣用氫氧化鈉溶液吸收,關閉C打開F時,由于溴化氫極易溶于水,廣口瓶中的水會倒吸入三頸燒瓶,
(1)根據溴苯的性質可知,溴苯是一種密度比水大的無色液體,在實驗中因為溶解了不量的溴而顯褐色,在三口燒瓶中鐵與溴生成溴化鐵,苯與溴在溴化鐵作催化劑的條件下了生取代反應生成溴苯和溴化氫;
(2)反應產生的溴化氫氣體遇到石蕊溶液,能石蕊溶液變紅色,溴化氫氣體通入硝酸銀溶液,能產生淺黃色沉淀;
(3)氫氧化鈉溶液能吸收溴化氫,倒置的漏斗能防止發生倒吸;
(4)三口燒瓶中的溴苯含有少量的溴和溴化氫,可以用NaOH溶液除去,溴苯不溶于水且密度比水大,據此答題.
解答 解:實驗室制備溴苯是用苯和液溴在鐵粉作催化劑的條件下發生取代反應生成溴苯和溴化氫,根據裝置圖可知,生成溴苯的同進還有溴化氫生成另外還有少部分溴揮發,所以在D裝置中石蕊會變紅,E中的硝酸銀會產生溴化銀沉淀,尾氣用氫氧化鈉溶液吸收,關閉C打開F時,由于溴化氫極易溶于水,廣口瓶中的水會倒吸入三頸燒瓶,
(1)在三口燒瓶中鐵與溴生成溴化鐵,苯與溴在溴化鐵作催化劑的條件下了生取代反應生成溴苯和溴化氫,所以有關反應的化學方程式分別是2Fe+3Br2=2FeBr3、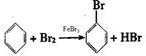 ,
,
故答案為:2Fe+3Br2=2FeBr3、 ;
;
(2)由于生成的溴化氫極易揮發,溶于水顯酸性,則紫色石蕊試液變紅,溴化氫溶于水和硝酸銀反應生成溴化銀淡黃色長的,即實驗現象是溶液中有淡黃色沉淀生成,所以D管石蕊試液變紅,E管出現淺黃色沉淀,
故答案為:D管石蕊試液變紅,E管出現淺黃色沉淀;
(3)氫氧化鈉溶液能吸收溴化氫,倒置的漏斗能防止發生倒吸,所以F的作用是吸收排出的溴化氫氣體,防止污染空氣,同時能防止倒吸,
故答案為:吸收排出的溴化氫氣體,防止污染空氣,同時能防止倒吸;
(4)溴苯含有少量的溴可以用NaOH溶液除去,溴苯不溶于水且密度比水大,將加過氫氧化鈉溶液的混合溶液倒入分液漏斗中,振蕩靜置后溴苯從分液漏斗的下口放出即可,故答案為:NaOH溶液.
點評 該題是高考中的常見題型,屬于中等難度的試題,試題綜合性強,難易適中.在注重對學生基礎性知識考查和訓練的同時,側重對學生能力的培養和解題方法的指導與訓練,有利于培養學生的嚴謹規范的實驗設計能力,也有利于提高學生的學科素養.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 雖然Cu能導電,但Cu是非電解質 | |
| B. | AgCl雖然難溶于水,但AgCl是電解質 | |
| C. | SO3、NH3的水溶液均能導電,所以SO3、NH3均是電解質 | |
| D. | KNO3溶液能導電,所以硝酸鉀溶液是電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 生成0.025 mol P2O5 | |
| B. | 生成 P2O3所釋放的熱量為(Y-0.05X) kJ | |
| C. | 2P(s)+$\frac{3}{2}$O2(g)=P2O3(s)△H=-(40Y-2X)kJ•mol-1 | |
| D. | 生成的 P2O3與 P2O5的質量之比為 1:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
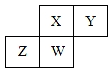 短周期元素X、Y、Z、W在元素周期表中的相對位置如圖所示,其中W原子的質子數是其最外層電子數的三倍,下列說法不正確的是( )
短周期元素X、Y、Z、W在元素周期表中的相對位置如圖所示,其中W原子的質子數是其最外層電子數的三倍,下列說法不正確的是( )| A. | 原子半徑:Z>W>X>Y | |
| B. | 最高價氧化物對應水化物的酸性:X>W>Z | |
| C. | 最簡單氣態氫化物的熱穩定性:Y>X>W>Z | |
| D. | ZY2晶體熔化、液態Y3氣化均需克服分子間作用力 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 化學鍵 | N-H | N-N | N≡N | O-H |
| 鍵能(kJ.mol-1) | 390 | 190 | 946 | 460 |

| 時間/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com