
【題目】2019年6月6日,工信部正式向四大運營商頒發了5G商用牌照,揭示了我國5G元年的起點。通信用鋰離子電池般需要體積小、重量輕、高溫性能突出、可高倍率充放電、綠色環保等眾多優點。請回答下列問題:
(1)LiCoO2、LiFePO4 常用作鋰離子電池的正極材料。基態Fe原子的價電子排布式為___基態Co原子核外電子的空間運動狀態有_______種。
(2)PO43-的空間構型是______,寫出與其互為等電子體的一種陰離子______,基態P原子的第一電離能為什么比基態S原子的第一電離能大:______。
(3)現有化學式為Co(NH3)5Cl3的配合物,1mol 該物質最多可以與2molAgNO3反應,則該配合物中鈷的配位數為______, 配體中N的雜化方式為_____,1mol 該配合物中含δ鍵數目為______NA。
(4)FeO是離子晶體,其晶格能可通過下圖的Bom-Haber循環計算得到。氣態電中性基態原子獲得一個電子變為氣態一價負離子放出的能量叫做第一電子親和能,由圖可知O原子的第一電子親和能為_____kJ·mol-1, FeO晶格能為_____kJ·mol-1。

(5)單質鋰晶體的結構如下圖,晶胞中鋰的配位數為____,晶胞的空間利用率為____(用含有n的表達式即可),若晶胞邊長為a pm, NA為阿伏加德羅常數,則金屬鋰的密度為_____ g cm-3。(寫出計算式)

【答案】3d64s2 15 正四面體 SO42-或ClO4-等 P原子的3p軌道是半充滿狀態,比較穩定,所以P原子的第一電離能比S的大 6 sp3 21 142 3902 8 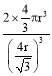 或
或![]()
![]() 或
或![]()
【解析】
(1)根據構造原理, Fe26號元素,屬于第四周期第Ⅷ族,基態原子的價電子排布式為3d64s2;核外電子的空間運動狀態指的是電子軌道,基態Co原子由1s、2s、2p(3個軌道)、3s、3p(3個軌道)、3d(5個軌道)、4s,故基態Co原子核外電子的空間運動狀態有15種;
(2)根據價層電子對互斥理論,PO43-的價層電子對數為4,空間構型是正四面體;等電子體指的是原子個數相同且價電子數相同的分子或離子,故與PO43互為等電子的陰離子由SO42、S2O32、ClO4 等等(答案合理即可);基態P原子的價電子排布3s23p3,基態S原子3s23p4,P的3p軌道處于半滿能量較低較穩定,不易失去電子,基態P原子的第一電離能比基態S原子的第一電離能大;
(3)1molCo(NH3)5Cl3配合物質最多與2molAgNO3反應,故可以寫為[Co(NH3)5Cl]Cl2,則該配合物中內界中5個氨分子和1個氯離子均為中心鈷離子的配體,故該配合物中鈷的配位數為6; 配體中N以單鍵形式與H鍵和,故雜化方式為sp3;每個該配合物中有6個配位鍵(也屬于δ鍵),每個氨分子由3個δ鍵,共含有δ鍵數目3×5+6=21,則含有1mol 該配合物中含δ鍵數目為21NA;
(4)根據第一電子親和能的定義,由圖可知氣態電中性基態氧原子O(g)得一個電子變為氣態一價負離子O(g)放出的熱量142kJ·mol-1,故O原子的第一電子親和能為142kJ·mol-1;根據定義,FeO晶格能是指在標準狀況下,使離子晶體FeO變成氣態正離子Fe2+(g)和負離子O2-(g)時所吸收的能量3902kJ·mol-1,因此由圖可知FeO晶格能為3902kJ·mol-1;
(5)單質鋰晶體是體心立方堆積,晶胞中鋰的配位數為8;根據堆積方式確定體對角線上的原子相切,故晶胞邊長a與原子半徑r的關系為![]() a=4r,晶胞的空間利用率=100%×
a=4r,晶胞的空間利用率=100%×![]() =
=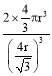 =
=![]() ;NA為阿伏加德羅常數,由原子均攤法計算得該晶胞中有2個K原子,則晶胞的質量為2×
;NA為阿伏加德羅常數,由原子均攤法計算得該晶胞中有2個K原子,則晶胞的質量為2×![]() ,邊長apm=
,邊長apm=![]() cm,故金屬鋰的密度為
cm,故金屬鋰的密度為![]() 或
或![]() 。
。


科目:高中化學 來源: 題型:
【題目】下列各選項中,物質之間通過一步反應就能實現如圖所示變化的是( )
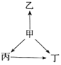
選項 | 甲 | 乙 | 丙 | 丁 |
A | Al | AlCl3 | Al2O3 | NaAlO2 |
B | S | H2S | SO2 | SO3 |
C | Na | Na2O | NaOH | Na2O2 |
D | N2 | NH3 | NO | NO2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煤的氣化是高效、清潔地利用煤炭的重要途徑之一.
(1)在25℃、101kPa時,H2與O2化合生成1molH2O(g)放出241.8kJ的熱量,其熱化學方程式為______.
又知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+![]() O2(g)═CO2(g)△H=-283.0kJ/mol
O2(g)═CO2(g)△H=-283.0kJ/mol
焦炭與水蒸氣反應是將固體煤變為氣體燃料的方法,C(s)+H2O(g)═CO(g)+H2(g)△H=______kJ/mol.
(2)CO可以與H2O(g)進一步發生反應:CO(g)+H2O(g)CO2(g)+H2(g)△H<0在甲、乙、丙三個恒容密閉容器中,起始時按照下表進行投料,在800℃時達到平衡狀態,K=1.0.
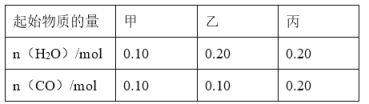
①該反應的平衡常數表達式為______.
②平衡時,甲容器中CO的轉化率是______;容器中CO的轉化率:乙______甲;丙______甲.(填“>”、“=”或“<”)
③丙容器中,通過改變溫度,使CO的平衡轉化率升高,則溫度______(填“升高”或“降低”).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】維拉帕米(又名異搏定)是治療心絞痛和原發性高血壓的藥物,合成路線中某一步驟如圖所示,下列說法中正確的是
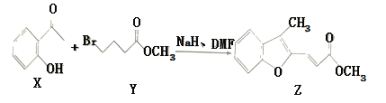
A. Y的分子式為C5H11O2 Br
B. 含苯環和羧基的ⅹ的同分異構體有4種
C. 可以用酸性高錳酸鉀溶液鑒別X和Z
D. 1mol Z最多可與6mol H2發生加成反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用新型甲醇燃料電池作電源電解硫酸銅溶液,下列有關說法不正確的是( )
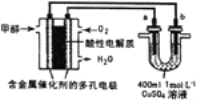
A.甲醇一極的電極反應式為CH3OH-6e-+H2O= CO2↑+6H+
B.若a為粗鋼,b為精銅,消耗標準狀況下224mL O2,則a極質量減少1.28g
C.若a. b均為石墨,a極反應為:2H2O-4e-= 4H+ +O2↑
D.若a為石墨,b為銅,消耗標準狀況下224mLO2,則電解后CuSO4溶液的pH為1(忽略溶液體積變化)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷的單質及其化合物用途非常廣泛。回答下列問題:
(1)基態磷原子價電子軌道表示式為______________________;磷的第一電離能比硫大,其原因是_____________________________________________。
(2)已知反應6P2H4==P4+ 8PH3↑。P2H4分子中磷原子雜化類型是________________;P4分子的幾何構型是________________________。
(3)N和P同主族。
①NH3的沸點比PH3高,其原因是_________________________;NH3分子中鍵角比PH3分子中鍵角大,其原因是______________________________________________。
②氮原子間可形成氮氮雙鍵或氮氮叁鍵,而磷原子之間難以形成雙鍵或叁鍵。從原子結構角度分析,原因是___________________________________________。
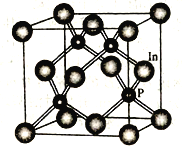
(4)磷化銦是一種半導體材料,其晶胞如下圖所示,晶胞參數為a nm。In 的配位數為_______________;與In原子間距離為![]() a nm 的In 原子有________個。
a nm 的In 原子有________個。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應NO2+CO=NO+CO2的能量變化如圖所示,下列說法正確的是( )
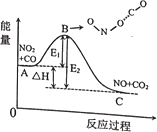
A.正反應是吸熱反應
B.E1表示逆反應的活化能
C.當NO2和CO系統的平均能量到達B處時,碰撞形成ONO…CO
D.A點表示NO2和CO系統的平均能量,此處兩分子發生碰撞并發生反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在2L的定容密閉容器中,X、Y、Z三種氣體的物質的量隨時間變化的曲線如圖所示,下列描述正確的是( )

A.反應開始到10s,用Z表示的反應速率為0.158mol/(L·s)
B.反應進行到10s后停止反應
C.反應開始時10s,Y的轉化率為79.0%
D.反應的化學方程式為:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硼鎂泥是一種工業廢料,主要成分是MgO(占40%),還有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等雜質,以此為原料制取的硫酸鎂可用于印染、造紙、醫藥等工業。從硼鎂泥中提取MgSO4·7H2O的流程如下:
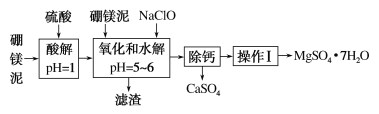
根據題意回答下列問題:
(1)實驗中需用1 mol·L-1的硫酸800 mL,若用18.4 mol·L-1的濃硫酸來配制,量取濃硫酸時,需使用的量筒的規格為________。
A 10 mL B 20 mL C 50 mL D 100 mL
(2)加入的NaClO可將Mn2+氧化為MnO2,反應的離子方程式為:___________________,還有一種離子也會被NaClO氧化,反應的離子方程式為______________________。
(3)濾渣的主要成分中除含有Fe(OH)3、Al(OH)3外還有_______________。
(4)在“除鈣”前,需檢驗濾液中Fe3+是否被除盡,簡述檢驗方法:____________________。
(5)已知MgSO4、CaSO4的溶解度如下表:
溫度/℃ | 40 | 50 | 60 | 70 |
S(MgSO4)/g | 30.9 | 33.4 | 35.6 | 36.9 |
S(CaSO4)/g | 0.210 | 0.207 | 0.201 | 0.193 |
“除鈣”是將MgSO4和CaSO4的混合溶液中的CaSO4除去,根據上表數據,可確定操作步驟為蒸發結晶、________________(填操作名稱)。
(6)實驗中提供的硼鎂泥共10 g,得到MgSO4·7H2O共17.22 g,則MgSO4·7H2O的產率為________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com