
【題目】鈦(Ti)被稱為繼鐵、鋁之后的第三金屬,鈦白(TiO2)是目前最好的白色顏料。制備TiO2和Ti的原料是鈦鐵礦,我國的鈦鐵儲量居世界首位。用含Fe2O3的鈦鐵礦(主要成分為FeTiO3)制備TiO2流程如下:

已知反應TiO2++2H2O![]() H2TiO3+2H+ ΔH<0
H2TiO3+2H+ ΔH<0
(1)步驟①加Fe的目的是___________________________________(用離子方程式表達);步驟②冷卻的目的是_________________________________________________________。
(2)上述制備TiO2的過程中,可以利用的副產物是__________________;考慮成本和廢物綜合利用因素,廢液中應加入______處理;在“水浸”步驟中加入大量的水即可獲得H2TiO3沉淀,請用相關化學原理解釋___________________________________________________。
(3)由金紅石(TiO2)制取單質鈦(Ti),涉及到的步驟為
![]() ―→
―→![]()
![]()
![]()
反應TiCl4+2Mg===2MgCl2+Ti在Ar氣氛中進行的理由是___________________________。
【答案】2Fe3++ Fe =3Fe2+析出綠礬(FeSO4·7H2O)綠礬(FeSO4·7H2O)生石灰(或碳酸鈣、廢堿)根據反應TiO2++2H2O![]() H2TiO3+2H+ ,加水稀釋濃度商小于其化學平衡常數,所以反應平衡正向移動,生成更多H2TiO3而形成沉淀防止高溫下鎂或鈦與O2、N2等反應
H2TiO3+2H+ ,加水稀釋濃度商小于其化學平衡常數,所以反應平衡正向移動,生成更多H2TiO3而形成沉淀防止高溫下鎂或鈦與O2、N2等反應
【解析】
(1)根據加入濃硫酸后,得到離子種類,步驟①加入鐵,發生Fe+2Fe3+=3Fe2+;過濾后得到FeSO4·7H2O,步驟②冷卻的目的是析出FeSO4·7H2O;
(2)根據流程制備的是TiO2,則FeSO4·7H2O屬于副產物;水浸時發生TiO2++2H2O![]() H2TiO3+2H+,廢液顯酸性,應加入CaO或CaCO3或堿進行處理;根據反應TiO2++2H2O
H2TiO3+2H+,廢液顯酸性,應加入CaO或CaCO3或堿進行處理;根據反應TiO2++2H2O![]() H2TiO3+2H+ ,加水稀釋濃度商小于其化學平衡常數,所以反應平衡正向移動,生成更多H2TiO3而形成沉淀;
H2TiO3+2H+ ,加水稀釋濃度商小于其化學平衡常數,所以反應平衡正向移動,生成更多H2TiO3而形成沉淀;
(3)Mg、Ti能與O2、N2發生反應,因此在Ar氛圍中,防止Mg、Ti與空氣中的O2、N2發生反應。


科目:高中化學 來源: 題型:
【題目】化學與科學、技術、社會、環境密切相關.下列有關說法中錯誤的是( )
A. 節日燃放的焰火是某些金屬元素焰色反應所呈現出來的色彩
B. 為防止中秋月餅等富脂食品因被氧化而變質,常在包裝袋中放入生石灰或硅膠
C. 小蘇打是制作饅頭和面包等糕點的膨松劑,還是治療胃酸過多的一種藥劑
D. 青銅是我國使用最早的合金材料,目前世界上使用量最大的合金材料是鋼鐵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溶于海水的CO2主要以4種無機碳形式存在,其中 HCO3-占95 % ,利用圖示裝置從海水中提取CO2,有利于減少環境溫室氣體含量。下列說法正確的是
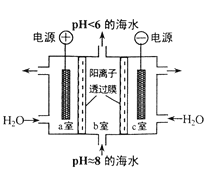
A. a 室排出的是NaOH 、Ca(OH)2等強堿性物質
B. 裝置中產生的 O2和提取的 CO2的體積比約為1:4
C. c室發生的反應為 2H2O-4e-===O2↑+ 4H+
D. 電路中每有0.2mol 電子通過時,就有0.2mol陽離子從c室移至b室
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知水在25 ℃和95 ℃時的電離平衡曲線如圖所示:
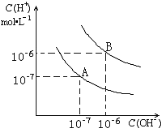
(1)25 ℃時水的電離平衡曲線應為__________ (填“A”或“B”)。
(2)95 ℃時水的離子積Kw=__________,c(H+)=__________
(3)25 ℃時,將pH=9的NaOH溶液與pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,則NaOH溶液與H2SO4溶液的體積比為_____。
(4)95 ℃時,若100 mL pH1=a的某強酸溶液與1 mL pH2=b的某強堿溶液混合后,所得溶液呈中性,則混合前,該強酸的pH1與強堿的pH2之間應滿足的關系是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】純堿是生活中常見的物質,請回答下列問題:
(1)寫出純堿在水溶液中電離的方程式:_________。
(2)純堿屬于“酸”“堿”“鹽”中的_____。
(3)現有 10.6 g 純堿,其物質的量為__________mol,將此固體溶于水配成 200 mL 溶液,其溶質的物 質的量濃度為_________ mol·L-1,取出 10 mL 此溶液加水稀釋至 100 mL,其溶質的物質的量濃度 為___ mol·L-1,稀釋后溶液中 Na+的物質的量為________ mol。
(4)①寫出少量 CO2 與 NaOH 溶液反應的離子方程式: _____________
②寫出過量 CO2 與 NaOH 溶液反應的離子方程式: _________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用,合成氨工業在國民生產中有重要意義。以下是關于合成氨的有關問題,請回答:
(1)若在一容積為2L的密閉容器中加入0.2mol的N2和0.6mol的H2,在一定條件下發生反應:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,若在5分鐘時反應達到平衡,此時測得NH3的物質的量為0.2mol。則前5分鐘的平均反應速率v(N2)=__。平衡時H2的轉化率為___。
2NH3(g) ΔH<0,若在5分鐘時反應達到平衡,此時測得NH3的物質的量為0.2mol。則前5分鐘的平均反應速率v(N2)=__。平衡時H2的轉化率為___。
(2)平衡后,若要提高H2的轉化率,可以采取的措施有___。
A.加了催化劑 B.增大容器體積
C.降低反應體系的溫度 D.加入一定量N2
(3)若在0.5L的密閉容器中,一定量的氮氣和氫氣進行如下反應:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化學平衡常數K與溫度T的關系如表所示:
2NH3(g) ΔH<0,其化學平衡常數K與溫度T的關系如表所示:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
請完成下列問題:
①試比較K1、K2的大小,K1___K2(填“<”、“>”或“=”);
②下列各項能作為判斷該反應達到化學平衡狀態的依據是___(填序號字母)
A.容器內N2、H2、NH3的物質的量濃度之比為1∶3∶2
B.v(N2)正=3v(H2)逆
C.容器內壓強保持不變
D.混合氣體的密度保持不變
③400℃時,反應2NH3(g)![]() N2(g)+3H2(g)的化學平衡常數為___。當測得NH3、N2和H2物質的量分別為3 mol、2 mol和 1 mol時,則該反應的v(N2)正___v(N2)逆(填“<”、“>”或“=”)。
N2(g)+3H2(g)的化學平衡常數為___。當測得NH3、N2和H2物質的量分別為3 mol、2 mol和 1 mol時,則該反應的v(N2)正___v(N2)逆(填“<”、“>”或“=”)。
(4)根據化學反應速率和化學平衡理論,聯系合成氨的生產實際,你認為下列說法不正確的是___。
A.化學反應速率理論可指導怎樣在一定時間內快出產品
B.勒夏特列原理可指導怎樣使用有限原料多出產品
C.催化劑的使用是提高產品產率的有效方法
D.正確利用化學反應速率和化學反應限度理論都可以提高化工生產的綜合經濟效益
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 萘(![]() )是最簡單的稠環芳香烴,萘與足量氫氣充分加成的產物一氯代物有2種
)是最簡單的稠環芳香烴,萘與足量氫氣充分加成的產物一氯代物有2種
B. 酚酞的結構如圖所示,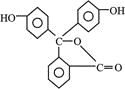 其結構中含有羥基(—OH),故酚酞屬于醇
其結構中含有羥基(—OH),故酚酞屬于醇
C. 溴水能將甲苯、己烯、CCl4、乙醇四種溶液鑒別開來
D. ![]() 的名稱為2-甲基-4-戊醇
的名稱為2-甲基-4-戊醇
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用純凈的CaCO3與100 mL稀鹽酸反應制取CO2,實驗過程記錄如圖所示(CO2的體積已折算為標準狀況下的體積)。下列分析正確的是( )
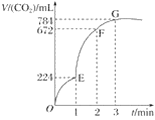
A. OE段表示的平均速率最快
B. EF段,用鹽酸表示該反應的平均反應速率為0.04 mol·L-1·min-1
C. OE、EF、FG三段中,該反應用二氧化碳表示的平均反應速率之比為2∶6∶7
D. G點表示收集的CO2的量最多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有鐵的氧化物樣品,用150 mL 5 mol/L的鹽酸恰好使其完全溶解,所得溶液還能吸收標準狀況下氯氣1.68L,使其中的Fe2+全部轉化為Fe3+,該樣品可能的化學式是( )
A.Fe2O3B.Fe3O4C.Fe5O7D.Fe4O5
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com