
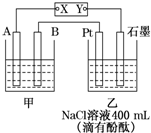
 如圖為相互串聯的甲乙兩個電解池,X、Y為直流電源的兩個電極.電解過程中,發現石墨電極附近先變紅.請回答:
如圖為相互串聯的甲乙兩個電解池,X、Y為直流電源的兩個電極.電解過程中,發現石墨電極附近先變紅.請回答:分析 (1)石墨電極附近先變紅,說明石墨附近氫離子濃度減小,氫氧根濃度增大,即石墨為陰極,則Y為負極,X為正極,Pt電極為陽極,陽極上氯離子失電子生成氯氣;
(2)甲池若為電解精煉銅的裝置,陰極銅離子得電子生成Cu,根據轉移電子守恒計算;
(3)根據電解方程式計算生成的氫氧根離子的物質的量濃度.
解答 解:(1)石墨電極附近先變紅,說明石墨附近氫離子濃度減小,氫氧根濃度增大,即石墨為陰極,則Y為負極,X為正極,Pt電極為陽極,陽極上氯離子失電子生成氯氣,則乙池中Pt電極上的電極反應式為2Cl--2e-═Cl2↑;
故答案為:正;2Cl--2e-═Cl2↑;
(2)甲池若為電解精煉銅的裝置,陰極銅離子得電子生成Cu,則Cu的物質的量為$\frac{12.8g}{64g/mol}$=0.2mol,由電極反應:Cu2++2e-=Cu可知,電解過程中共有0.4mol電子轉移,乙池中陰極上電極反應為2H++2e-=H2↑,由電子守恒可知,生成的氫氣為0.2mol,其體積為4.48L;
故答案為:4.48 L;0.4;
(3)電解氯化鈉溶液的離子方程式為2H2O+2Cl-$\frac{\underline{\;通電\;}}{\;}$H2↑+Cl2↑+2OH-,反應中轉移0.4mol電子,則生成氫氧根離子為0.4mol,所以c(OH-)=$\frac{0.4mol}{0.4L}$=1mol•L-1;
故答案為:1mol•L-1.
點評 本題考查了電解池的工作原理的應用、電極判斷方法、電極反應的書寫、電子守恒的計算應用等,注意把握串聯電解池轉移電子守恒是解題關鍵,題目難度中等,側重于考查學生的分析能力和對基礎知識的應用能力.


 陽光課堂課時作業系列答案
陽光課堂課時作業系列答案 鷹派教輔銜接教材河北教育出版社系列答案
鷹派教輔銜接教材河北教育出版社系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 模擬對象 | 類推結論 | |
| A | 2HCl+Mg═MgCl2+H2↑ | H2SO4+2Na═Na2SO4+H2↑ |
| B | Cl2+2Fe2+═2 Fe3++2Cl- | I2+2Fe2+═2Fe3++2I- |
| C | Mg在O2中燃燒生成MgO | Na在O2中燃燒生成Na2O |
| D | Al在NaOH溶液中反應可產生H2 | Mg與NaOH溶液反應也可以產生H2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定是CO2 | B. | 一定是SO2 | ||
| C. | 可能是CO2或SO2 | D. | 一定是CO2和SO2混合氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1013的溶液中:NH4+、Ca2+、Cl-、K+ | |
| B. | Kw/c(OH-)=1.0mol•L-1的溶液中:Mg2+、NO3、NH4+、I- | |
| C. | 中性溶液中:K+、Cl-、Na+、CO32- | |
| D. | 無色溶液中:Fe3+、Cl-、Na+、SCN- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
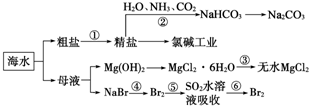
| A. | 過程①中除去粗鹽中的SO${\;}_{4}^{2-}$、Ca2+、Mg2+、Fe3+等雜質,加入的藥品順序為:Na2CO3溶液→NaOH溶液→BaCl2溶液→過濾后加鹽酸 | |
| B. | 過程②中應先通入NH3再通入CO2氣體 | |
| C. | 過程③中結晶出的MgCl2•6H2O要在HCl氛圍中加熱脫水制得無水MgCl2 | |
| D. | 從第⑤~⑥步的目的是濃縮、富集溴單質 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| X | Y | |
| Z | W |
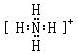 ,Y的氣態氫化物的穩定性比Z的氣態氫化物的穩定性強(填“強”、或“弱”).
,Y的氣態氫化物的穩定性比Z的氣態氫化物的穩定性強(填“強”、或“弱”).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 用如圖裝置(夾持、加熱裝置已略)進行實驗,由②中現象,不能證實①中反應發生的是( )
用如圖裝置(夾持、加熱裝置已略)進行實驗,由②中現象,不能證實①中反應發生的是( )| ①中實驗 | ②中現象 | |
| A | 鐵粉與水蒸氣加熱 | 肥皂水冒泡 |
| B | 加熱NH4Cl和Ca(OH)2混合物 | 酚酞溶液變紅 |
| C | NaHC03固體受熱分解 | 澄済石灰水變渾濁 |
| D | 石蠟油在碎瓷片上受熱分解 | Br2的CCl4溶液褪色 |
| A. | 答案A | B. | 答案B | C. | 答案C | D. | 答案D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (或
(或
 ).
).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com